网址:http://m.1010jiajiao.com/timu3_id_389085[举报]
 含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.已知:
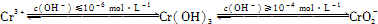
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.
①写出Cr2O
2- 7 |
②用离子方程式表示溶液pH不能超过10的原因:
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O
2- 7 |
①写出阴极的电极反应式:
②电解法中加入氯化钠的作用是
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为
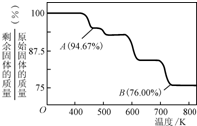
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时剩余固体的成分是
(12分).KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过
液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再
用镍板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:

回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、
Si的氧化物含量较高,会导致KOH消耗量偏高,用方程式表示KOH消耗偏高的原因
、 。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工
艺相比,电解法的优势是 、 。
查看习题详情和答案>>
(12分).KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过
液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再
用镍板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、
Si的氧化物含量较高,会导致KOH消耗量偏高,用方程式表示KOH消耗偏高的原因
、 。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工
艺相比,电解法的优势是 、 。
查看习题详情和答案>>
KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用镍板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:

回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、
Si的氧化物含量较高,会导致KOH消耗量偏高,用方程式表示KOH消耗偏高的原因
、 。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工艺相比,电解法的优势是 、 。
查看习题详情和答案>>.KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过
液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再
用镍板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
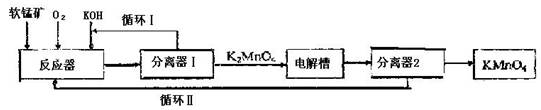
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、
Si的氧化物含量较高,会导致KOH消耗量偏高,用方程式表示KOH消耗偏高的原因
、 。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工
艺相比,电解法的优势是 、 。
查看习题详情和答案>>