摘要:写在题目上
网址:http://m.1010jiajiao.com/timu3_id_389074[举报]
题目
(8分)氯气与石灰乳反应可制得漂白粉,氯气在工业上可以由电解饱和食盐水来制备,产生氯气的同时,还得到氢气和氢氧化钠,称为“氯碱工业”。请回答下列问题:
(1)请写出电解饱和食盐水的化学方程式。
(2)若电解饱和食盐水时消耗氯化钠234g,试计算理论上最多可得到氯气(标准状况下)的体积为多少?
(3)若用上述制得的氯气制取漂白粉,理论上最多能得到漂白粉多少克?
查看习题详情和答案>> 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
(1)写出该反应的反应方程式:
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
;并指明该氧化还原反应的还原剂是
| ||
铁
铁
,氧化剂是水
水
.(2)实验前必须对整套装置进行气密性检查,操作方法是
在玻璃管口A处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好
在玻璃管口A处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好
.(3)试管中收集气体是
氢气
氢气
,如果要在A处玻璃管处点燃该气体,则必须对该气体进行验纯
验纯
,方法是用试管收集一试管气体,靠近酒精灯火焰,如果发出的声音是“啪”的爆鸣声,则证明产生的氢气不纯(含有氧气),如果是“噗”的声音,则证明是纯净的氢气
用试管收集一试管气体,靠近酒精灯火焰,如果发出的声音是“啪”的爆鸣声,则证明产生的氢气不纯(含有氧气),如果是“噗”的声音,则证明是纯净的氢气
.这一操作的目的是防止点燃时,氢气因含有氧气而爆炸
防止点燃时,氢气因含有氧气而爆炸
.目前世界上60%的镁是从海水中提取的.海水提镁的主要流程如下:
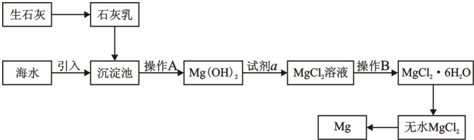
请回答下列问题:
(1)从离子反应的角度思考,向海水中加入石灰乳的作用是
(2)石灰乳是生石灰与水形成的混合物,从充分利用海洋化学资源、提高经济效益的角度,生产生石灰的主要原料来源于海洋中的
(3)操作A是
(4)加入的足量试剂a是
(5)无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,该反应的化学方程式是
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
查看习题详情和答案>>

请回答下列问题:
(1)从离子反应的角度思考,向海水中加入石灰乳的作用是
沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀)
沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀)
,写出在沉淀池中反应的离子方程式Mg2++2OH-═Mg(OH)2↓
Mg2++2OH-═Mg(OH)2↓
.(2)石灰乳是生石灰与水形成的混合物,从充分利用海洋化学资源、提高经济效益的角度,生产生石灰的主要原料来源于海洋中的
贝壳(或牡蛎壳等)
贝壳(或牡蛎壳等)
.(3)操作A是
过滤
过滤
,操作B是加热浓缩(或蒸发结晶)
加热浓缩(或蒸发结晶)
.(4)加入的足量试剂a是
HCl
HCl
(填化学式).(5)无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,该反应的化学方程式是
MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
.从考虑成本和废物循环利用的角度,副产物氯气可以用于
| ||
制盐酸,循环使用
制盐酸,循环使用
.(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低
海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低
.目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的
(3)操作A是
(4)加入的足量试剂a是
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你
查看习题详情和答案>>

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是
沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀)
沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀)
,写出在沉淀池的离子方程式Mg2++2OH-═Mg(OH)2↓
Mg2++2OH-═Mg(OH)2↓
.(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的
贝壳
贝壳
.(3)操作A是
过滤
过滤
,操作B是加热浓缩
加热浓缩
.(4)加入的足量试剂a是
HCl
HCl
(填化学式).(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
.从考虑成本和废物循环利用的角度,副产物氯气可以用于
| ||
制盐酸,循环使用
制盐酸,循环使用
.(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,
且成本低.
且成本低.
海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,
且成本低.
.且成本低.
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你
不同意
不同意
(填“同意”或“不同意”)该同学的想法,理由是MgO熔点很高,熔融时耗费大量的能量而增加生产成本
MgO熔点很高,熔融时耗费大量的能量而增加生产成本
.目前世界上60%的镁是从海水中提取的,如图是某工厂从海水中提取镁的主要步骤.学生就这个课题展开了讨论.

学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?有三个学生提出自己的观点.
学生甲的观点:直接往海水中加入沉淀剂.
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂.
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂.
通过分析比较你认为学生
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,并充分利用当地的贝壳(主要成分为碳酸钙)资源,加入的足量试剂①是
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
A.蒸馏 B.过滤 C.萃取 D.分液
(3)加入的足量试剂②是
(4)写出由无水MgCl2制取金属镁的化学方程式
查看习题详情和答案>>

学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?有三个学生提出自己的观点.
学生甲的观点:直接往海水中加入沉淀剂.
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂.
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂.
通过分析比较你认为学生
丙
丙
的观点正确(填学生序号),简述理由:镁离子富集浓度高;能源消耗小,成本低.
镁离子富集浓度高;能源消耗小,成本低.
.(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,并充分利用当地的贝壳(主要成分为碳酸钙)资源,加入的足量试剂①是
Ca(OH)2(或CaO)
Ca(OH)2(或CaO)
(填化学式).(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
B
B
(填标号字母)A.蒸馏 B.过滤 C.萃取 D.分液
(3)加入的足量试剂②是
HCl
HCl
(填化学式).(4)写出由无水MgCl2制取金属镁的化学方程式
MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||