摘要:生产H2SO4质量分数为98%的硫酸1000吨.理论上需硫磺多少吨?
网址:http://m.1010jiajiao.com/timu3_id_388812[举报]
无机化合物在化工生产和科学研究中发挥着重要的作用.根据题意完成下列计算:
1.一定温度下,将60 mL CO、CO2与O2的混合气体用电火花引燃,完全反应后冷却到原来温度,体积减少了10 mL.将反应后的气体通过足量的NaOH(aq),体积又减少了30 mL.剩余气体可使带余烬的木条复燃.原混合气中CO的体积为________mL,CO2的体积为________mL.
2.标准状况下CO与CO2混合气体的平均相对分子质量为32.将该气体完全通入盛有足量Na2O2的容积为2.24升的密闭容器中(忽略固体物质的体积),引燃,完全反应后,容器内固体生成物的质量为________g.
3.将Fe2O3溶于150 mL稀H2SO4中,待Fe2O3完全溶解后,加入铁粉,产生气体3.36 L(标准状况),溶液中不再有Fe和Fe3+.已知加入的铁粉和氧化铁共19.2 g,计算:
(1)Fe2O3的质量为________g;
(2)稀H2SO4物质的量浓度为________.
4.取5.64 g Cu(NO3)2无水晶体,强热使其分解,得到NO2、O2和2.32固体氧化物.将气体用水充分吸收后,还有气体剩余,同时得到100 mL溶液.请通过计算确定:(写出计算过程)
(1)所得溶液的物质的量浓度;
(2)残留固体的成分和质量分别是多少克?
(分)利用黄铁矿为原料制取硫酸,在煅烧时矿石中硫的利用率为98%,在接触氧化时二氧化硫的转化率为90%。煅烧1t含硫质量分数为48%的矿石,能生产多少吨H2SO4质量分数为98%的硫酸?
查看习题详情和答案>>第一代自来水生产工艺是“混凝-沉淀、过滤、消毒”净水工艺,流程如下: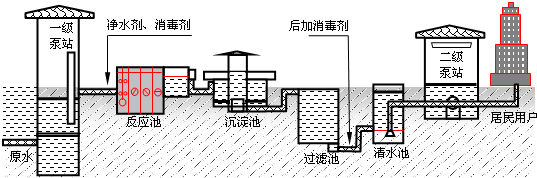
(1)生产中用到净水剂,下列物质有净水作用的是
A.石灰石 B.氧化铁 C.氯化铁 D.明矾
(2)上图生产流程中常用的消毒剂是氯气,写出氯气与水反应的离子方程式
(3)生产过程中两次加入消毒剂,其中“后加消毒剂”的目的是
A.使供水管网保持足够的余氯,防止水在管网中再次受到污染
B.氯气有毒,且很不稳定,一次加入会加大自来水的毒性
C.如果一次性加入,氯气会堵塞管网,所以必须分两次加入
D.氯气难溶于水,一次加入时难全部溶解
(4)上述消毒用的氯气是电解饱和食盐水制取的,写出阴极的电极反应式
查看习题详情和答案>>

(1)生产中用到净水剂,下列物质有净水作用的是
CD
CD
.A.石灰石 B.氧化铁 C.氯化铁 D.明矾
(2)上图生产流程中常用的消毒剂是氯气,写出氯气与水反应的离子方程式
Cl2+H2O HClO+H++Cl-
HClO+H++Cl-
 HClO+H++Cl-
HClO+H++Cl-Cl2+H2O HClO+H++Cl-
HClO+H++Cl-
,其中起消毒作用的成分是 HClO+H++Cl-
HClO+H++Cl-次氯酸
次氯酸
(填写名称);二氧化氯已被联合国卫生组织(WHO)列为AⅠ级消毒剂.二氧化氯(ClO2)消毒能力是等质量氯气的2.63倍.用氯酸钠(NaClO3)和硫酸酸化的H2O2反应制备ClO2.请写出该反应的化学方程式2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
.(3)生产过程中两次加入消毒剂,其中“后加消毒剂”的目的是
A
A
A.使供水管网保持足够的余氯,防止水在管网中再次受到污染
B.氯气有毒,且很不稳定,一次加入会加大自来水的毒性
C.如果一次性加入,氯气会堵塞管网,所以必须分两次加入
D.氯气难溶于水,一次加入时难全部溶解
(4)上述消毒用的氯气是电解饱和食盐水制取的,写出阴极的电极反应式
2H++2e-=H2↑
2H++2e-=H2↑
.(2013?江苏二模)过氧化钙晶体[CaO2?8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液.广泛应用于环境杀菌、消毒等领域.
★过氧化钙晶体的制备
工业上生产CaO2?8H2O的主要流程如下:

(1)用上述方法制取CaO2?8H2O的化学方程式是
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30mL蒸馏水和10mL 2.000mol?L-1 H2SO4,用0.0200mol?L-1KMnO4标准溶液滴定至终点.重复上述操作两次.H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为
(4)根据表1数据,计算产品中CaO2?8H2O的质量分数(写出计算过程)
表1.KMnO4标准溶液滴定数据
查看习题详情和答案>>
★过氧化钙晶体的制备
工业上生产CaO2?8H2O的主要流程如下:

(1)用上述方法制取CaO2?8H2O的化学方程式是
CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl
CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl
.(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①
温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解)
温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解)
;②通入过量NH3使溶液呈碱性,抑制CaO2?8H2O的溶解(或使溶液呈碱性,减少CaO2?8H2O的溶解,或提高产品的产率.意思相近均给分)
通入过量NH3使溶液呈碱性,抑制CaO2?8H2O的溶解(或使溶液呈碱性,减少CaO2?8H2O的溶解,或提高产品的产率.意思相近均给分)
.★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30mL蒸馏水和10mL 2.000mol?L-1 H2SO4,用0.0200mol?L-1KMnO4标准溶液滴定至终点.重复上述操作两次.H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为
当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色
当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色
.(4)根据表1数据,计算产品中CaO2?8H2O的质量分数(写出计算过程)
表1.KMnO4标准溶液滴定数据
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
根据关系式:5(CaO2?8H2O)~5H2O2~2KMnO4;n(KMnO4)=
n(CaO2?8H2O)=
×0.0200 mol?L-1×23.03mL×10-3L?mL-1=1.151×10-3 mol、故 CaO2?8H2O的质量分数为:
×100%=82.91%.
| 5 |
| 2 |
| 5 |
| 2 |
| 1.51×10-3mol×216g?mol-1 |
| 0.3000g |
根据关系式:5(CaO2?8H2O)~5H2O2~2KMnO4;n(KMnO4)=
n(CaO2?8H2O)=
×0.0200 mol?L-1×23.03mL×10-3L?mL-1=1.151×10-3 mol、故 CaO2?8H2O的质量分数为:
×100%=82.91%.
.| 5 |
| 2 |
| 5 |
| 2 |
| 1.51×10-3mol×216g?mol-1 |
| 0.3000g |
Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a .
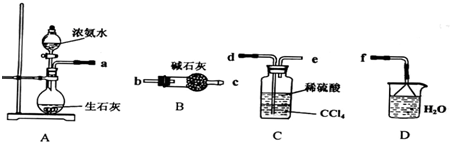
(2)将装置C中两种液体分离开的操作名称是 .装置D的作用是 .
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下:
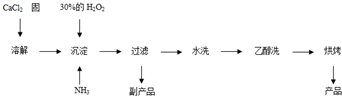
已知CaO2?8H2O呈白色,微溶于水.I2+2S2O32-=2I-+S4O62-
(1)用上述方法制取CaO2?8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
①判断此滴定实验达到终点的方法是: .
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”).
查看习题详情和答案>>

(2)将装置C中两种液体分离开的操作名称是
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下:

已知CaO2?8H2O呈白色,微溶于水.I2+2S2O32-=2I-+S4O62-
(1)用上述方法制取CaO2?8H2O的化学方程式是
(2)检验“水洗”是否合格的方法是
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
①判断此滴定实验达到终点的方法是:
②CaO2的质量分数为
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能