网址:http://m.1010jiajiao.com/timu3_id_388620[举报]
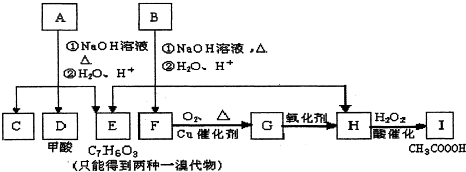
(1)写出E的结构简式______.
(2)A有2种可能的结构,写出相应的结构简式______.
(3)在化合物B、C、D、F、G、I中,互为同系物的是______.
(4)写出下列的反应方程式和反应类型
B与NaOH溶液反应的化学反应方程式______,反应类型______.
D与足量的银氨溶液反应的化学反应方程式______,反应类型______
(5)E有多种同分异构体,请写出能满足下列3个条件的所有同分异构体的结构简式:______
①能发生银镜反应,②苯环上的一溴代物有两种,③不存在一0-0-键.
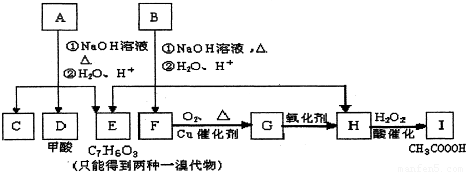
(1)写出E的结构简式______.
(2)A有2种可能的结构,写出相应的结构简式______.
(3)在化合物B、C、D、F、G、I中,互为同系物的是______.
(4)写出下列的反应方程式和反应类型
B与NaOH溶液反应的化学反应方程式______,反应类型______.
D与足量的银氨溶液反应的化学反应方程式______,反应类型______
(5)E有多种同分异构体,请写出能满足下列3个条件的所有同分异构体的结构简式:______
①能发生银镜反应,②苯环上的一溴代物有两种,③不存在一0-0-键.
查看习题详情和答案>>
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。

已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
A.过滤 B.蒸发结晶 C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度。进行如下两个实验,实验过程中有关反应为:
i.
ii.ICl+KI=I2+KCl
iii.I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将0.500g该油脂样品溶于10mL四氯化碳后,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol•L—1的Na2S2O3,标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小”)。
③0.500g该油脂样品所消耗的ICl的物质的量为______mol。由此数据经换算即可求得该油脂的不饱和度。
查看习题详情和答案>>
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
i.

ii.ICl+KI=I2+KCl
iii.I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将0.500g该油脂样品溶于10mL四氯化碳后,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol?L—1的Na2S2O3,标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小”)。
③0.500g该油脂样品所消耗的ICl的物质的量为______mol。由此数据经换算即可求得该油脂的不饱和度。 查看习题详情和答案>>
 芳香化合物A、B互为同分异构体,B的结构简式是 CH3COO- -COOCH2CH3 ,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
芳香化合物A、B互为同分异构体,B的结构简式是 CH3COO- -COOCH2CH3 ,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
(1)B可以发生的反应类型有(填序号)_______________.
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
B的核磁共振氢谱中会出现_______个峰.
(2)E中含有官能团的名称是__________________.
(3)A有两种可能的结构,其对应的结构简式为________________、______________.
(4)B、C、D、F、G化合物中互为同系物的是_________________.
(5)F与H在浓硫酸作用下加热时发生反应的方程式为_________________________.