网址:http://m.1010jiajiao.com/timu3_id_38844[举报]
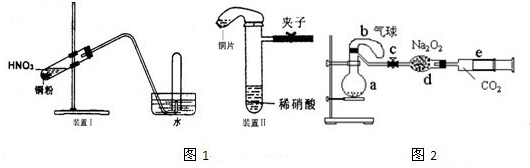
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为______.
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是______.于是他设计装置Ⅱ,其中装铜片的是气球.
(3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如图2:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶.b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球.(整套装置已经过气密性检查合格.)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是______;
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:______;
③打开弹簧夹将二氧化碳慢慢推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳______ml;
④将上述全过程用一个总的化学方程式表示:______.

请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为______.
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是______.于是他设计装置Ⅱ,其中装铜片的是气球.
(3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如图2:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶.b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球.(整套装置已经过气密性检查合格.)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是______;
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:______;
③打开弹簧夹将二氧化碳慢慢推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳______ml;
④将上述全过程用一个总的化学方程式表示:______.
查看习题详情和答案>>
 某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
[实验一]:研究性学习小组甲以铜为电极电解饱和食盐水,探究过程如下:
实验过程:按如图装置,接通电源后,阴极产生大量气泡;阳极铜丝由粗变细,不久出现砖红色浑浊,最后在试管底部聚集砖红色沉淀,溶液始终未出现蓝色.
查阅资料:某些铜的化合物有关性质如表所示:
| 物质 | 性质 | 物质 | 性质 |
| 氯化铜 | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜 | 白色 |
| 氧化亚铜 | 砖红色,在酸性条件下易反应: Cu2O+2H+=Cu+Cu2++H2O. Cu2O在空气中灼烧生成CuO | 氢氧化亚铜 | 橙黄色,不稳定 |
(1)试管底部砖红色沉淀的化学式为______.
(2)写出电解总反应方程式______.
[实验二]研究性学习小组乙为检测[实验一]生成的砖红色沉淀中是否含有Cu,设计了以下两种方案进行探究.
方案1:取少量砖红色沉淀溶于足量的浓硝酸中,观察溶液颜色变化.
方案2:取一定质量砖红色沉淀在空气中充分灼烧,根据灼烧前后质量变化进行判断.
(3)请你评价方案1和方案2是否合理,并简述其原因.
方案1______.
方案2______.
思考与交流:实验结束后,同学们关于[实验二]中“方案一”溶液呈绿色,而不呈蓝色展开了讨论.丙同学认为是该溶液中硝酸铜的质量分数较高所致;丁同学则认为是该溶液中溶解了生成的气体.
(4)同学们分别设计了以下4个实验来判断两种看法是否正确.这些方案中不可行的是(选填序号字母)______.
A、加热该绿色溶液,观察颜色变化.
B、加水稀释绿色溶液,观察颜色变化
C、向该绿色溶液中通入氧气,观察颜色变化
D、向饱和的硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化. 查看习题详情和答案>>

【实验探究】
(1)探究浓硝酸的强氧化性
将过量铜片置于具支试管的底部,通过分液漏斗往具支试管中加入少量浓硝酸,用排水法收集产生的气体。
①在具支试管中观察到实验现象是__________________________________。
②具支试管中发生反应的化学方程式为:____________________________。
(2)探究稀硝酸的强氧化性
①上述反应完成后,欲进一步探究稀硝酸的强氧化性,紧接着简便、合理的实验操作是:
________________________________________________________。
②能证明稀硝酸与铜反应的还原产物为NO的实验现象是______________(填标号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
【实验反思】
(1)某同学提出,实验过程中若操作不慎,易出现倒吸现象。对该实验装置进行改进的方案是:可在b与c之间连接____________________________(填装置的名称)。
(2)利用该装置先进行铜与浓硝酸的反应,再进行铜与稀硝酸反应的实验顺序的合理性是:
_____________________________________________________________________。
【问题讨论】
在用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)分别反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。针对此现象,同学们进行讨论,提出两种意见:
①认为两溶液所显颜色不同的原因,是因为Cu2+浓度的差异引起的。
②认为前者溶液呈绿色是因为生成的红棕色NO2气体溶解于溶液中引起的。
你认为上述意见______________(填“①”或“②”)合理。(注:若选填①,下题中只答Ⅰ;若选填②,下题中只答Ⅱ)Ⅰ.如果你认为合理,理由是____________________________。
Ⅱ.如果你认为合理,请设计一个简单的实验进行验证:____________________________。
查看习题详情和答案>>某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如下图所示:
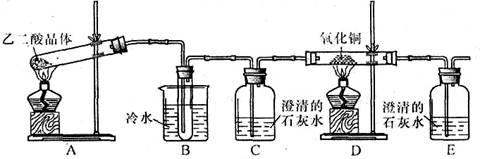
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式: ;
(2)装置B的作用是 ;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是 ; 。
(3)实验结束后向装置B的试管中加入NaHCO3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是 。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组进一步探究:[来源:Zxxk.Com]
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是 。
②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L。则红色固体中含单质铜的质量分数是 。
查看习题详情和答案>>