题目内容
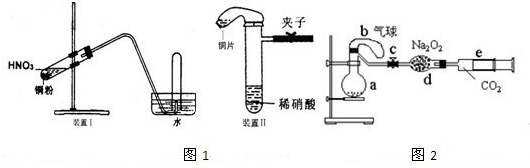
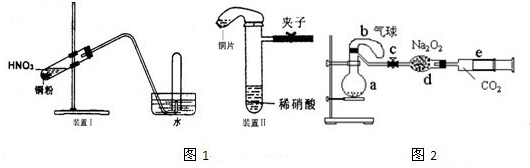
图1是化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图.其中装置Ⅰ为甲同学设计.(可能用到的相对原子质量:H:1 C:12 N:14 O:16 Cu:64 )
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为______.
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是______.于是他设计装置Ⅱ,其中装铜片的是气球.
(3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如图2:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶.b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球.(整套装置已经过气密性检查合格.)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是______;
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:______;
③打开弹簧夹将二氧化碳慢慢推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳______ml;
④将上述全过程用一个总的化学方程式表示:______.

请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为______.
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是______.于是他设计装置Ⅱ,其中装铜片的是气球.
(3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如图2:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶.b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球.(整套装置已经过气密性检查合格.)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是______;
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:______;
③打开弹簧夹将二氧化碳慢慢推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳______ml;
④将上述全过程用一个总的化学方程式表示:______.
(1)Cu与稀硝酸反应生成硝酸铜、NO和水,发生的离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)装置Ⅰ中利用排水法收集,因为NO2与水反应也可产生NO:3NO2+H2O=2HNO3+NO,故不能肯定生成的NO气体是来自于铜与稀硝酸反应,
故答案为:NO2与水反应也可产生NO:3NO2+H2O=2HNO3+NO,故不能肯定生成的NO气体是来自于铜与稀硝酸反应;
(3)①Cu与硝酸生成硝酸铜溶液,生成NO气体,NO与氧气反应生成二氧化氮,则观察到溶液变蓝色,烧瓶内气体由无色继而变成红色,气球变大,
故答案为:溶液变蓝色,烧瓶内气体由无色继而变成红色,气球胀大;
②气体逐渐减少,氮的氧化物转化为硝酸发生NO2+O2+2H2O═4HNO3、或4NO+3O2+2H2O═4HNO3,
故答案为:NO2+O2+2H2O═4HNO3、或4NO+3O2+2H2O═4HNO3;
③n(Cu)=
=0.006mol,由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,被硝酸氧化的Cu为
=0.0045mol/L,
则被氧气氧化的Cu为0.006mol-0.0045mol=0.0015mol,
由2Na2O2+2CO2═2Na2CO3+O2、
4NO+3O2+2H2O=4HNO3,
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
总反应为2Cu+4HNO3+O2═2Cu(NO3)2+2H2O可知,
2Cu~O2~2CO2,n(O2)=0.003mol×22.4L/mol=0.0672L=67.2mL,
a中盛有标况下的空气(氧气占五分之一),烧瓶为250mL,
则氧气占(250-10)×0.25=48mL,
所以参加反应的氧气为67.2mL-48mL=19.2mL,
V(CO2)=2×19.2mL=38.4mL,故答案为:38.4mL;
④上述过程的总反应为2Cu+4HNO3+O2═2Cu(NO3)2+2H2O,故答案为:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O.
(2)装置Ⅰ中利用排水法收集,因为NO2与水反应也可产生NO:3NO2+H2O=2HNO3+NO,故不能肯定生成的NO气体是来自于铜与稀硝酸反应,
故答案为:NO2与水反应也可产生NO:3NO2+H2O=2HNO3+NO,故不能肯定生成的NO气体是来自于铜与稀硝酸反应;
(3)①Cu与硝酸生成硝酸铜溶液,生成NO气体,NO与氧气反应生成二氧化氮,则观察到溶液变蓝色,烧瓶内气体由无色继而变成红色,气球变大,
故答案为:溶液变蓝色,烧瓶内气体由无色继而变成红色,气球胀大;
②气体逐渐减少,氮的氧化物转化为硝酸发生NO2+O2+2H2O═4HNO3、或4NO+3O2+2H2O═4HNO3,
故答案为:NO2+O2+2H2O═4HNO3、或4NO+3O2+2H2O═4HNO3;
③n(Cu)=
| 0.384g |
| 64g/mol |
0.01L×1.2mol/L×
| ||
| 2 |
则被氧气氧化的Cu为0.006mol-0.0045mol=0.0015mol,
由2Na2O2+2CO2═2Na2CO3+O2、
4NO+3O2+2H2O=4HNO3,
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
总反应为2Cu+4HNO3+O2═2Cu(NO3)2+2H2O可知,
2Cu~O2~2CO2,n(O2)=0.003mol×22.4L/mol=0.0672L=67.2mL,
a中盛有标况下的空气(氧气占五分之一),烧瓶为250mL,
则氧气占(250-10)×0.25=48mL,
所以参加反应的氧气为67.2mL-48mL=19.2mL,
V(CO2)=2×19.2mL=38.4mL,故答案为:38.4mL;
④上述过程的总反应为2Cu+4HNO3+O2═2Cu(NO3)2+2H2O,故答案为:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O.

练习册系列答案
相关题目