网址:http://m.1010jiajiao.com/timu3_id_388362[举报]
实验时可供选择的试剂有:①未知浓度的NaOH溶液;②37%盐酸;③40%硫酸;④14%盐酸;⑤大理石;⑥K2CO3固体.
实验室现有如下仪器:铁架台、启普发生器、量筒、烧杯、乳胶管、玻璃导管、玻璃棒、分液漏斗.
下表所列为有关物质在常温时溶解度(g/100 g水):
|
Na2CO3 |
NaHCO3 |
NaCl |
Na2SO4 |
NaHSO4 |
NaOH |
|
15.9 |
8.40 |
35.8 |
35.5 |
20.0 |
40.0 |
(1)本实验应选用的仪器,除启普发生器、乳胶管、玻璃导管外,还应有______________.
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品除①外,还应需要_____________.
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装不必叙述).
①量取两份相同体积的NaOH溶液;②_______________________________;③______
_______________________________.
(4)根据给出的溶解度数据,若保证在配制过程中不析出晶体,所用NaOH溶液中含有NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明).
查看习题详情和答案>>
将MgCl2溶液加入NaOH和Na2CO3的混合溶液中,溶液中的离子反应如下:先发生Mg2++2OH-===Mg(OH)2↓,后发生Mg2++CO![]() ===MgCO3↓;经查溶解度表得知, Mg(OH)2的溶解度小于MgCO3的溶解度。在溶解度表中有这样一组数据,表示四种物质在水中、液氨中的溶解度(g溶质/100 g溶剂),如下表:
===MgCO3↓;经查溶解度表得知, Mg(OH)2的溶解度小于MgCO3的溶解度。在溶解度表中有这样一组数据,表示四种物质在水中、液氨中的溶解度(g溶质/100 g溶剂),如下表:
| 溶质 溶剂 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水 | 170 | 9.3 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
(1)分别是1.0 mol· L-1的Ag+、Ba2+、NO![]() 和Cl-在水中发生反应的离子方程式是______________________________________________________________。
和Cl-在水中发生反应的离子方程式是______________________________________________________________。
(2)分别是0.50 mol· L-1的以上四种离子在液氨中发生反应的离子方程式是__________________________________________________。
II(6分)、某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有
 Fe3+、Ba2+、K+、OH-、NO3-、
Fe3+、Ba2+、K+、OH-、NO3-、![]() 、
、![]() 。为了进一步确认,对该溶液进行实验检测:
。为了进一步确认,对该溶液进行实验检测:
①仔细观察,该溶液呈无色、透明、均一状态。
②向100mL溶液中滴入稀硫酸,有23.3g白色沉淀产生,再加稀硝酸,白色沉淀不消失。回答下列问题:由此可知,除了含有Na+、Mg2+、Cl-外,该溶液中肯定还含有的离子及其物质的量浓度为___________,肯定没有的离子是___________,可能含有的离子是___________。
III(6分).试样X由氧化亚铁和氧化铜组成。取质量相等的两份试样进行下图所示实验:

(1)写出步骤③发生的全部反应的离子方程式。
(2)若Y和Z充分反应,生成的不溶物的质量是m,则每份试样X中氧化铜的质量为 (用m表示)。
查看习题详情和答案>>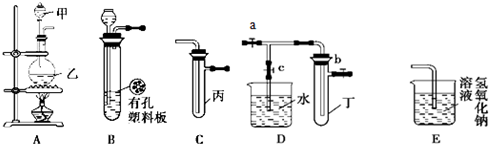
请按要求填空:?
(1)利用B装置可制取的气体有
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:?
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
(4)B中发生反应的化学方程式为
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为