网址:http://m.1010jiajiao.com/timu3_id_388207[举报]
为了测定某种含有Na2O杂质的Na2O2试样的纯度,3个课外活动小组分别设计了如下三个实验方案。首先准确称量出要进行反应的样品的质量m g,然后,将按照以下方案进行实验:
方案一:将样品与水充分反应,使产生的气体与加热的铜粉充分反应,测定反应后生成的氧化铜的质量为n g,通过计算求出试样中的含量。
(1)按照此方案,则试样中Na2O2的含量为 (用含 m、n的式子表示)
a(Na2O2)% ==
(2)此方案测定的结果误差较大,主要原因是:
方案二:将样品与实验生成的二氧化碳反应,通过测定反应产生的气体的体积,计算求出试样中Na2O2的含量。
(1)按照此方案,以下制取二氧化碳和进行反应使用的仪器的连接次序是
(填写仪器的编号)
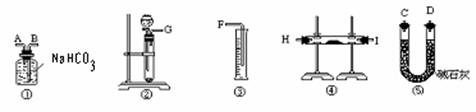
(2)通过①仪器的气体从流向上看,次序为 进 出(填写导管的字母)
方案三:将样品与水充分反应,测定出反应后的溶液的准确体积VL,因为体积较大,再从反应后的溶液中,取一定的准确的体积为V1ml溶液,装入锥形瓶中,用标准浓度的盐酸进行滴定,测定出样品与水反应后所得到的溶液的浓度,再计算求出试样中Na2O2的含量。
(1) 按照此方案,进行酸碱中和滴定时,最后一步操作应该选择的下列仪器中的
(填写仪器的编号)


(2)选择甲基橙做指示剂,确定终点的现象应该是溶液颜色由 变 并且半分钟内不变你认为方案二、方案三中测定结果最准的是
查看习题详情和答案>>Ⅰ.玻璃棒是中学化学实验中常用的仪器.下列实验过程中,一般不需要用玻璃棒的是
______(填写编号)
①用pH试纸测定Na2CO3溶液的pH; ②配制一定物质的量浓度的氯化钠溶液; ③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体; ④探究Ba(OH)28H2O晶体和NH4Cl晶体反应过程中的能量变化; ⑤用蒸馏法分离两种沸点差距较大的液体; ⑥过滤分离互不相溶的固体和液体; ⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程; ⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案.
方案一准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)此方案中,酸碱中和滴定时应选用指示剂是______.
方案二准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.

(2)该方案的实验过程中,仪器的连接顺序是______(填仪器下方序号),①中的进气口为______(填“A”或“B”)
(3)装置⑤的作用是______.
(4)在可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,请设计一种最简单的测定Na2O2纯度的实验方案______.
查看习题详情和答案>>
______(填写编号)
①用pH试纸测定Na2CO3溶液的pH; ②配制一定物质的量浓度的氯化钠溶液; ③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体; ④探究Ba(OH)28H2O晶体和NH4Cl晶体反应过程中的能量变化; ⑤用蒸馏法分离两种沸点差距较大的液体; ⑥过滤分离互不相溶的固体和液体; ⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程; ⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案.
方案一准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)此方案中,酸碱中和滴定时应选用指示剂是______.
方案二准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.
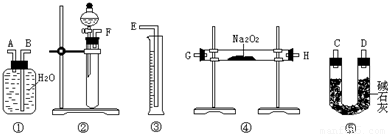
(2)该方案的实验过程中,仪器的连接顺序是______(填仪器下方序号),①中的进气口为______(填“A”或“B”)
(3)装置⑤的作用是______.
(4)在可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,请设计一种最简单的测定Na2O2纯度的实验方案______.
查看习题详情和答案>>
①用pH试纸测定Na2CO3溶液的pH; ②配制一定物质的量浓度的氯化钠溶液; ③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体; ④探究Ba(OH)28H2O晶体和NH4Cl晶体反应过程中的能量变化; ⑤用蒸馏法分离两种沸点差距较大的液体; ⑥过滤分离互不相溶的固体和液体; ⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程; ⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案.
方案一准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)此方案中,酸碱中和滴定时应选用指示剂是
方案二准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.

(2)该方案的实验过程中,仪器的连接顺序是
(3)装置⑤的作用是
(4)在可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,请设计一种最简单的测定Na2O2纯度的实验方案
①用pH试纸测定Na2CO3溶液的pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)28H20晶体和NH4Cl晶体反应过程中的能量变化
⑤用蒸馏法分离两种沸点差距较大的液体
⑥过滤分离互不相溶的固体和液体
⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程
⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案.
[方案一]准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)此方案中,酸碱中和滴定时应选用
(2)写出此方案中涉及到的反应的离子方程式
[方案二]准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.
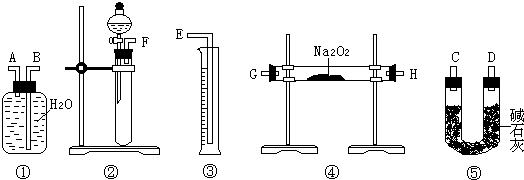
(3)该方案的实验过程中,如图,仪器的连接顺序是
(4)装置⑤的作用是
(5)你认为方案一、方案二中测定结果比较准确的是