摘要:10.下列是几种原子的基态电子排布式.其中电负性最大的原子是 A.1s22s22p4 B.1s22s22p63s23p3 C.1s22s22p63s23p2 C.1s22s22p63s23p64s2
网址:http://m.1010jiajiao.com/timu3_id_387983[举报]
请回答下列问题:
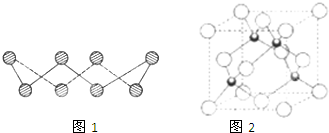
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为
(3)34号元素的价层电子的电子排布图为
(4)气态SO2分子的立体构型为
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为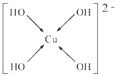
 .
.
(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是
查看习题详情和答案>>

(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
sp3
sp3
.(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为
Al>Mg
Al>Mg
;O与F电负性大到小的顺序为F>O
F>O
.(用<或=或>表示)(3)34号元素的价层电子的电子排布图为
1s22s22p63s23p63d104s24p4
1s22s22p63s23p63d104s24p4
,在周期表位于第四周期第ⅥA族
第四周期第ⅥA族
区;Mn2+基态的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
.(4)气态SO2分子的立体构型为
V形
V形
;SO32-离子的立体构型为三角锥型
三角锥型
(均用文字描述)(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:
酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离
酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离
;②H2SeO4比H2SeO3酸性强的原因:
H2SeO4和H2SeO3可以分别表示为(HO)2SeO2、(HO)2SeO,H2SeO3中Se为+4价,而H2SeO4中Se为+6价,后者Se原子吸电子能力强,导致羟基上氢原子更容易电离H+
H2SeO4和H2SeO3可以分别表示为(HO)2SeO2、(HO)2SeO,H2SeO3中Se为+4价,而H2SeO4中Se为+6价,后者Se原子吸电子能力强,导致羟基上氢原子更容易电离H+
;(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为


(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是
CuCl
CuCl
.如图是元素周期表的一部分,表中所列字母分别代表一种化学元素:
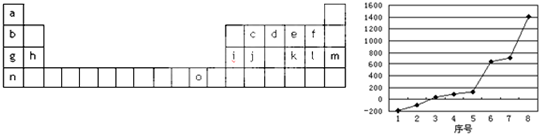
试回答下列问题:
(1)按电子排布,可把周期表中的元素划分成5个区,其中j位于 区.
(2)请写出字母o代表的元素的基态原子外围电子排布式 .
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号).
(4)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶体类型与晶体j相同.两者相比熔点更高的是 (填化学式),试从结构角度加以解释: .
(5)COCl2俗称光气,分子中C原子采取 杂化方式成键;分子中的共价键含有 (填标号).
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1个π键
(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2]分子的空间构型是 .若A在水中溶解度较大,B在CCl4中溶解度较大,试画出A分子的几何构型图 .
查看习题详情和答案>>

试回答下列问题:
(1)按电子排布,可把周期表中的元素划分成5个区,其中j位于
(2)请写出字母o代表的元素的基态原子外围电子排布式
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表
(4)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶体类型与晶体j相同.两者相比熔点更高的是
(5)COCl2俗称光气,分子中C原子采取
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1个π键
(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2]分子的空间构型是
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是____________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________________________________________________________________________。
(3)X与Z中电负性较大的是________。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为________,此离子中所含化学键的类型是________,X—Z—X的键角________109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为________,与一个X离子距离最近的所有的Y离子为顶点的几何体为________。该化合物与MgO相比,熔点较高的是________。
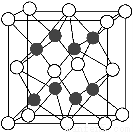
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看习题详情和答案>>
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是____________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________________________________________________________________________。
(3)X与Z中电负性较大的是________。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为________,此离子中所含化学键的类型是________,X—Z—X的键角________109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为________,与一个X离子距离最近的所有的Y离子为顶点的几何体为________。该化合物与MgO相比,熔点较高的是________。

(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
(1)R的基态原子的核外电子排布式是____________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________________________________________________________________________。
(3)X与Z中电负性较大的是________。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为________,此离子中所含化学键的类型是________,X—Z—X的键角________109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为________,与一个X离子距离最近的所有的Y离子为顶点的几何体为________。该化合物与MgO相比,熔点较高的是________。

(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
下表是元素周期表的一部分,表中所列字母分别代表一种化学元素:


试回答下列问题:
(1 )
) 按电子排布,可把周期表中的元素划分成5个区,其中j位于 区。
按电子排布,可把周期表中的元素划分成5个区,其中j位于 区。
(2)请写出字母o代表的元素的基态原子外围电子排布式 。
(3)第三周期8种元素按单质熔点高低的顺序如图,其中 序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号)。
序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号)。

(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶体类型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:
。
(5)COCl2俗称光气,分子中C原子采取 杂化方式成键;分子中的共价键含有 (填标号)。
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1 个π键
个π键
(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2] 分子的空间构型
是 。若A在水中溶解度较大,B在CCl4中溶解度较大,试画出A分子的几何构型图 。


试回答下列问题:
(1
 )
) 按电子排布,可把周期表中的元素划分成5个区,其中j位于 区。
按电子排布,可把周期表中的元素划分成5个区,其中j位于 区。(2)请写出字母o代表的元素的基态原子外围电子排布式 。
(3)第三周期8种元素按单质熔点高低的顺序如图,其中
 序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号)。
序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号)。
(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶体类型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:
。
(5)COCl2俗称光气,分子中C原子采取 杂化方式成键;分子中的共价键含有 (填标号)。
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1
 个π键
个π键(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2] 分子的空间构型
是 。若A在水中溶解度较大,B在CCl4中溶解度较大,试画出A分子的几何构型图 。