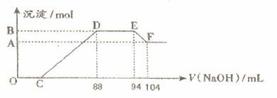
摘要:实验研究发现.硝酸发生氧化还原反应时.硝酸的浓度越稀.对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应.反应过程中无气体放出.在反应结束后的溶液中.逐滴加入5mol·L的NaOH溶液.所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示.则 (1)B与A的差值为: mol. (2) C点对应的溶液体积为: mL. (3)原硝酸溶液中含硝酸的物质的量为: mol.
网址:http://m.1010jiajiao.com/timu3_id_387111[举报]
 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.问题:(1)铁粉与铝粉的混合物与该浓度硝酸反应后,溶液中的阳离子除了Al3+、Fe3+、另外还有
NH4+
NH4+
、H+
H+
(填离子符号)(2)B与A的差值为
0.008
0.008
mol(3)写出DE段离子反应方程式
NH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
(4)原混合物中铝粉与铁粉的物质的量之比为
1:3
1:3
.(5)原硝酸溶液中含硝酸的物质的量为
0.148
0.148
mol. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的镁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的镁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:(1)OC段没有沉淀生成,此阶段发生反应的离子方程式为:
H++OH-═H2O
H++OH-═H2O
.(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:
NH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
(3)B与A的差值为
0.008
0.008
mol,C点对应的氢氧化钠溶液的体积为7
7
mL.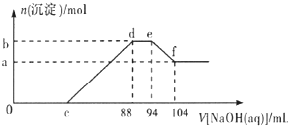 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的 化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL )与产生沉淀的物质的量( mol)关系如图所示,下列说法不正确的是( )
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的 化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL )与产生沉淀的物质的量( mol)关系如图所示,下列说法不正确的是( )| A、稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 | B、c点对应NaOH溶液的体积为48 mL | C、b点与a点的差值为0.05 mol | D、样品中铝粉和铁粉的物质的量之比为5:3 |