摘要:0.1mol/L的NaOH溶液0.2L.通入44.8mLH2S.所得溶液离子浓度大小关系正确的是 A.c(Na+)>c(OH-)>c(S2-) >c(HS-) B.c(Na+)=c(H2S)+c(HS-)+c(S2-) C.c(Na+)+ c(H+)= c(HS-)+c(S2-)+c(OH-) D.c(S2-)+c(OH-)=c(H+)+c(H2S)
网址:http://m.1010jiajiao.com/timu3_id_386866[举报]
下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D 中选择:
A.M>N B.M<N C.M=N D.无法比较
(1)相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2L 0.5mol?L-1NH4Cl溶液中NH4+的个数:
(2)相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度:
(3)两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+):
(4)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-):
(5)将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值:
(6)常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-):
(7)同温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol?L-1FeCl3溶液中Fe3+ 的水解百分率:
(8)室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度:
(9)pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是:
查看习题详情和答案>>
A.M>N B.M<N C.M=N D.无法比较
(1)相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2L 0.5mol?L-1NH4Cl溶液中NH4+的个数:
A
A
;(2)相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度:
B
B
;(3)两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+):
B
B
;(4)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-):
B
B
;(5)将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值:
B
B
;(6)常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-):
B
B
;(7)同温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol?L-1FeCl3溶液中Fe3+ 的水解百分率:
B
B
;(8)室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度:
D
D
;(9)pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是:
A
A
.(2013?漳州二模)发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:
(1)该过程中产生的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K=
.
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式
(3)“催化还原”反应制乙二醇原理如下:CH3OOC-COOCH3(g)+4H2(g)?HOCH2-CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究.如图表示乙二醇达到平衡时的产率随原料投料比[n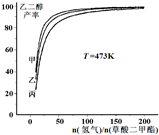 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①草酸氢钾溶液中存在如下平衡:H2O?H++OH-、HC2O4-?H++C2O42-和
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-) d.c(K+)>c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为
查看习题详情和答案>>

(1)该过程中产生的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K=
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式
CH3OH(l)+3/
O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol
| 3 |
| 2 |
CH3OH(l)+3/
O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol
.| 3 |
| 2 |
(3)“催化还原”反应制乙二醇原理如下:CH3OOC-COOCH3(g)+4H2(g)?HOCH2-CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究.如图表示乙二醇达到平衡时的产率随原料投料比[n
 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=3.5MPa
3.5MPa
.(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①草酸氢钾溶液中存在如下平衡:H2O?H++OH-、HC2O4-?H++C2O42-和
HC2O4-+H2O?H2C2O4+OH-
HC2O4-+H2O?H2C2O4+OH-
.②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是
ad
ad
(填序号).a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-) d.c(K+)>c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为
CH3OH+H2O-6e-=CO2+6H+
CH3OH+H2O-6e-=CO2+6H+
;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替32g甲醇,所需标准状况下的甲烷的体积为16.8
16.8
L.(2012?唐山三模)(1)常温下,浓度均为0.1mol/L的6种溶液的pH如下表:
①上述溶液中的阴离子结合H+能力最弱的为
②结合表中数据分析,与0.1mol/L的CH3OONa溶液中水的电离程度相同的是(填字母代号)
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
E.pH=8.8的Na2CO3溶液
F.0.1mol/L的CH3COONH4溶液
③将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度由大到小的顺序为
④100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的e溶液的pH=n,则c(H+)+c(HCN)
(2)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则该反应的化学平衡常数K的表达式为
若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如下:
①判断下列说法正确的是
A.增大压强,可以提高CH3OH的转化率
B.平衡时再向容器中加入CH3OCH3和水蒸气各1mol,平衡不移动
C.平衡后升高温度,K>400
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率不变
②达平衡时体系总能量减少
查看习题详情和答案>>
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5Na |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
CH3COO-
CH3COO-
,d溶液呈碱性的原因是ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(用离子方程式表示).②结合表中数据分析,与0.1mol/L的CH3OONa溶液中水的电离程度相同的是(填字母代号)
BE
BE
.A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
E.pH=8.8的Na2CO3溶液
F.0.1mol/L的CH3COONH4溶液
③将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度由大到小的顺序为
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
.④100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的e溶液的pH=n,则c(H+)+c(HCN)
10n-12
10n-12
mol/L.(2)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则该反应的化学平衡常数K的表达式为
K=
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
K=
.| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如下:
| 物质 | CH3OH | CHO3CH3 | H2O |
| 浓度/mol/L | 0.8 | 1.24 | 1.24 |
D
D
(填字母代号).A.增大压强,可以提高CH3OH的转化率
B.平衡时再向容器中加入CH3OCH3和水蒸气各1mol,平衡不移动
C.平衡后升高温度,K>400
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率不变
②达平衡时体系总能量减少
31
31
kJ.25℃时0.1mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中的
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若乙的解释正确,溶液的pH应
(3)常温下将0.010mol CH3COONa和0.004mol HCl溶于水,配制成0.5L混合溶液.判断:
①溶液中共有
②其中有两种粒子的物质的量之和一定等于0.010mol,它们是
③溶液中n(CH3COO-)+n(OH-)-n(H+)=
查看习题详情和答案>>
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中的
B
B
(填写编号),然后测定溶液的pH(已知25℃时,CH3COONH4溶液呈中性).A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若乙的解释正确,溶液的pH应
增大
增大
(填“增大”“减小”或“不变”).(3)常温下将0.010mol CH3COONa和0.004mol HCl溶于水,配制成0.5L混合溶液.判断:
①溶液中共有
7
7
种粒子;②其中有两种粒子的物质的量之和一定等于0.010mol,它们是
CH3COOH
CH3COOH
和CH3COO-
CH3COO-
;③溶液中n(CH3COO-)+n(OH-)-n(H+)=
0.006
0.006
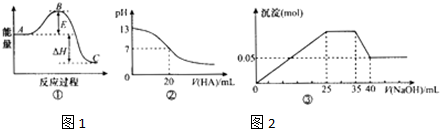
mol.下列表述中一定正确的是( )

| A、若图①中曲线表示3H2(g)+N2(g)?2NH3(g),反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快 | B、图②可表示25℃时,用0.1mol/L的CH3COOH溶液滴定20mL 0.1mol/L NaOH溶液,溶液的pH随加入的酸的体积的变化情况 | C、若图③表示向含Mg2+、Al3+、NH4+、Cl-的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为10mol/L | D、若图③表示向含Mg2+、Al3+、NH4+、Cl-的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则n(Mg2+):n(Al3+ ):n(NH4+)=2:3:2 |