摘要:4.1mol物质中含有的粒子数约为6.02×1023.下列叙述中正确的是 A.室温下.22.4L乙烷和乙烯的混合气体中含有的C原子数约为6.02×1023 B.标准状况下.11.2LCCl4含有的分子数约为0.5×6.02×1023 C.常温常压下.17gH2O2中含有的中子数约为8×6.02×1023 D.0.5L0.5mol/L的NaNO3溶液中含有的粒子总数约为0.5×6.02×1023
网址:http://m.1010jiajiao.com/timu3_id_386786[举报]
氮、磷、硫的化合物种类繁多,应用广泛.
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序是 .
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质中含有的Fe2+的核外电子排布式为 ,存在的化学键有离子键、 和 .
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是 ;碳原子采取sp杂化,1mol该物质中含有的π键数目为 .
②H2O2常温下是液体,沸点较高(150℃),其主要原因是 .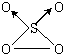
(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物质中S原子的轨道杂化方式是 ,该分子属于 分子 (填“极性”、“非极性”).
查看习题详情和答案>>
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序是
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质中含有的Fe2+的核外电子排布式为
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是
②H2O2常温下是液体,沸点较高(150℃),其主要原因是

(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物质中S原子的轨道杂化方式是
下列有关定量判断正确的是( )
| A、18gH218O分子中含有的10NA个质子 | B、将3mol NO2完全溶于水,生成NO气体,气体的物质的量变为2mol | C、将1.5molCO2气体通入到1L 1mol/L的NaOH溶液中,生成1mol碳酸钠 | D、2Cu2S+2H2SO4+5O2═4CuSO4+2H2O反应中,当1mol O2发生反应时,还原剂所失电子的物质的量为4mol |
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
①12.4g白磷晶体中含有的P-P键数约是0.6NA;
②电解精炼铜时转移了NA个电子,阳极溶解32g铜;
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA;
⑤2.9g 2CaSO4?H2O含有的结晶水分子数为0.02NA(2CaSO4?H2O式量为290);
⑥含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA;
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA.
①12.4g白磷晶体中含有的P-P键数约是0.6NA;
②电解精炼铜时转移了NA个电子,阳极溶解32g铜;
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA;
⑤2.9g 2CaSO4?H2O含有的结晶水分子数为0.02NA(2CaSO4?H2O式量为290);
⑥含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA;
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA.
查看习题详情和答案>>
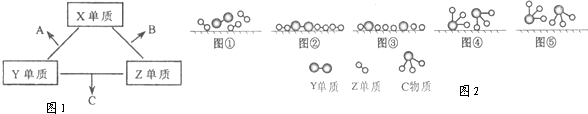
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图1变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是 周期, 族.
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们 .
(3)C的电子式是 ; Z单质与Y单质在固体催化剂表面合成C的反应过程,示意如图2.
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是 .
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K= ;用物质C表示该反应的反应速率为 .
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式 .用该反应合成1mol液态甲醇吸收热量131.9kJ,
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式 .
查看习题详情和答案>>

(1)X元素在周期表中的位置是
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们
(3)C的电子式是
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K=
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及图1所示装置制取NaHCO3,反应的化学方程式为:
NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl.然后再将NaHCO3制成Na2CO3.
(1)装置乙的作用是
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线c 对应的溶液中的离子是
(4)若取10.5g NaHCO3固体,加热了t1min后,剩余固体的质量为7.4g.如果把此剩余固体全部加入到200mL 1mol/L的盐酸中,则充分反应后溶液中H+的物质的量浓度为
查看习题详情和答案>>
NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl.然后再将NaHCO3制成Na2CO3.
(1)装置乙的作用是
吸收HCl
吸收HCl
.为防止污染空气,尾气中含有的NH3
NH3
需要进行吸收处理.(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
过滤
过滤
、洗涤、灼烧.(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线c 对应的溶液中的离子是
HCO3-
HCO3-
(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是1:2
1:2
.(4)若取10.5g NaHCO3固体,加热了t1min后,剩余固体的质量为7.4g.如果把此剩余固体全部加入到200mL 1mol/L的盐酸中,则充分反应后溶液中H+的物质的量浓度为
0.375mol/L
0.375mol/L
(设溶液体积变化忽略不计).