网址:http://m.1010jiajiao.com/timu3_id_386779[举报]
(1)若配制大约1 mol·L-1的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是__________(选填字母序号)。
A.氢氧化钠固体 B.浓硫酸(98%) C.浓盐酸(37%) D.浓硝酸(63%)
(2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。
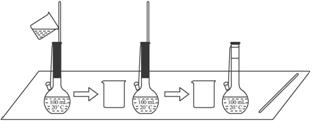
该步操作对所得溶液浓度的影响是__________(填“偏高”“偏低”或“无影响”),原因是_______
_____________________________________________________________________。
(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?_______
____________________________________________________________________。
(4)现用移液管准确量取20.0 mL 0.100 mol·L-1的碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2—3滴,此时溶液呈__________色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成__________色时即达到滴定终点,此时消耗盐酸体积为21.36 mL,则待测盐酸的浓度为__________ mol·L-1。
查看习题详情和答案>>配制一定物质的量浓度的溶液是实验室进行科学研究的重要环节。
(1)若配制大约1 mol·L-1叫的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是 (填字母序号)。
A.氢氧化钠固体B.浓硫酸(98%) C.浓盐酸(37%) D.浓硝酸(63%)
(2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。
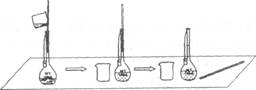
该步操作对所得溶液浓度的影响是 (填“偏高”、“偏低”或“无影响”),原因是
.
(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?
.
(4)现用移液管准确量取20.0 mI。0.100 mol·L-1盼碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2~3滴,此时溶液呈 色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成 色时即达到滴定终点,此时消耗盐酸体积为21.36 mI。,则待测盐酸的浓度为 mol·L-1。
查看习题详情和答案>>(1)若配制大约1 mol·L-1 的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是________(填字母序号)。
A.氢氧化钠固体 B.浓硫酸(98%) C.浓盐酸(37%) D.浓硝酸(63%)
(2)下图所示是某学生在配制0.100 mol·L-1 的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。

(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?
____________________________________。
(1)若配制大约1 mol·L-1叫的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是 (填字母序号)。
| A.氢氧化钠固体 | B.浓硫酸(98%) | C.浓盐酸(37%) | D.浓硝酸(63%) |

该步操作对所得溶液浓度的影响是 (填“偏高”、“偏低”或“无影响”),原因是
.
(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?
.
(4)现用移液管准确量取20.0 mI。0.100 mol·L-1盼碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2~3滴,此时溶液呈 色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成 色时即达到滴定终点,此时消耗盐酸体积为21.36 mI。,则待测盐酸的浓度为 mol·L-1。
(1)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.配制溶液时,若在最后一次读数时俯视读数,则导致实验结果偏大.
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大.
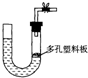
(2)右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓硫酸和亚硫酸钠制取二氧化硫
D.电石和水制取乙炔
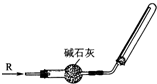
(3)实验室可用右下图所示装置干燥收集某气体R,则R可能是
A.S02 B.NH3
C.NO D.Cl2
(4)某同学如右图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是
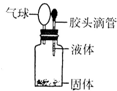
A.铜与浓硫酸 B.铁与浓硫酸
C.铝和氢氧化钠溶液 D.二氧化锰和浓盐酸
(5)指出下面3个实验中各存在的一个错误
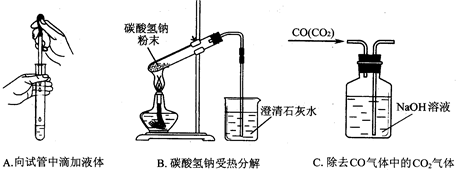
A