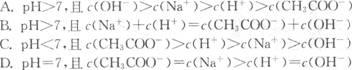摘要:10.常温下.将稀NaOH溶液与稀CH.COOH溶液混合.不可能出现的结果是 ( )
网址:http://m.1010jiajiao.com/timu3_id_386771[举报]
有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液,NH4Cl溶液,盐酸和Na2SO4溶液中的一种.
(1)已知A、B的溶液中水的电离程度相同,A、C溶液pH相同,A是 溶液,B是 溶液,C是 .
(2)常温下,将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是 .
A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.pH>7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.pH>7,且c(CH3COO-)>c(H+)>c(Na+)=c(OH-)
查看习题详情和答案>>
(1)已知A、B的溶液中水的电离程度相同,A、C溶液pH相同,A是
(2)常温下,将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.pH>7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.pH>7,且c(CH3COO-)>c(H+)>c(Na+)=c(OH-)
下列对于溶液中的问题叙述正确的是( )
A.向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小
B.在稀溶液中:H+(aq) + OH-(aq) = H2O(l); △H=-57.3kJ/mol,则含1 mol HClO的稀溶液和含1 mol KOH的稀溶液完全反应放出的热量等于57.3 kJ
C.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况
查看习题详情和答案>>
下列对于溶液中的问题叙述正确的是
A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小
B.对于水的电离而言,加入强酸、强碱会促进水电离,而加入弱酸、弱碱则会抑制水电离
C.5mL 0.02mol/L HCl溶液与5mL 0.02mol/L Ba(OH)2溶液混合,经充分反应后,如果溶液体积为10mL,则溶液的pH=12
D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH—)>c(Na+)>c(H+)>c(CH3COO—)的情况
查看习题详情和答案>>