网址:http://m.1010jiajiao.com/timu3_id_38621[举报]
 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅:SiO2+2C
| ||
②粗硅与干燥的Cl2反应制得SiCl4:Si+2C12
| ||
③SiCl4被过量的H2在1 000~1 100℃时还原制得纯硅:SiCl4+2H2
| ||
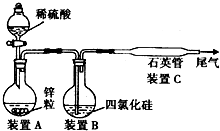
某同学从资料中查知:SiCl4的熔点为-7O℃,沸点为57.6℃,且在潮湿的空气中能发生水解反应.该同学设计了如下制取纯硅的实验装置(热源及夹持装置已略去).请回答下列问题:
(1)使SiCl4从装置B中逸出与H2充分混合,应采取的措施是
(2)装置C不能采用普通玻璃管的原因是
(3)如果从装置A中快速向装置B中通入气体,可能观察到的现象是
(4)为防止空气污染,含有SiCl4的尾气要通入盛有
(5)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是
①高温下用碳还原二氧化硅制得粗硅
![]()
③SiHCl3与过量H2在1 000—1
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请完成下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
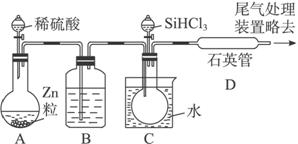
①装置B中的试剂是_______________________。装置C中的烧瓶需要加热,其目的是___________________________________。
②反应一段时间后,装置D中观察到的现象是__________________________,装置D不能采用普通玻璃管的原因是___________________________________,装置D中发生反应的化学方程式为_______________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________。
查看习题详情和答案>>①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
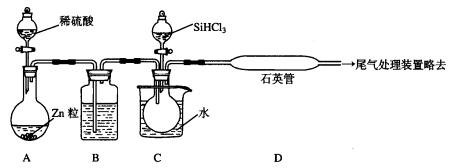
①装置B中的试剂是_________________________。
装置C中的烧瓶需要加热,其目的是_____________________________________。
②反应一段时间后,装置D中观察到的现象是______________________________________,装置D不能采用普通玻璃管的原因是____________________________________,装置D中发生反应的化学方程式为__________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_________________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看习题详情和答案>>①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
③SiHCl与过量H2在1 000—1 100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自然。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为__________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为_______。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图1-3-8(热源及夹持装置略去):
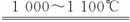
图1-3-8
①装置B中的试剂是_______。
装置C中的烧瓶需要加热,其目的是_____________________________________________。
②反应一段时间后,装置D中观察到的现象是______________________________________。
装置D不能采用普通玻璃管的原因是_______________,装置D中发生反应的化学方程式为______________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_______。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_______。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看习题详情和答案>>晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl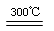 SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):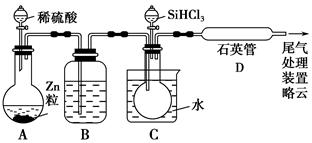
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。