摘要:2.有合成氨3H2+N22NH3 现有A.B.C.D四只容器中.每个容器中有两种操作.两种操作分别达到平衡后.N2和NH3转化率之和不为1的是: A.恒温恒容:操作一:加1mol N2和3mol H2, 操作二:加2molNH3 B.恒温恒压:操作一:加1mol N2和3mol H2, 操作二:加2molNH3 C.恒温恒容:操作一:加1mol N2和3mol H2, 操作二:加3molNH3 D.恒温恒压:操作一:加1mol N2和3mol H2, 操作二:加3molNH3
网址:http://m.1010jiajiao.com/timu3_id_386025[举报]
碳及其化合物有广泛的用途.
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作 极.
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作 极,反应的离子方程式 .
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 .
A.升高温度 B.增加碳的用量
C.加入催化剂 D.用CO吸收剂除去CO
(3)将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)得到如下数据:
通过计算,该反应的平衡常数为: .
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图1:
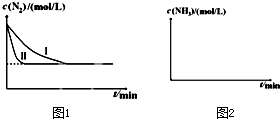
①与实验Ⅰ比较,实验Ⅱ改变的条件为: .
②实验Ⅲ比实验I的温度要高,其它条件相同,请在图2画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图.
查看习题详情和答案>>
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是
A.升高温度 B.增加碳的用量
C.加入催化剂 D.用CO吸收剂除去CO
(3)将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)得到如下数据:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图1:

①与实验Ⅰ比较,实验Ⅱ改变的条件为:
②实验Ⅲ比实验I的温度要高,其它条件相同,请在图2画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:

(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
2NH3,
阳极反应式为:3H2-6e-=6H+,则阴极反应式为
(3)工业中常用以下反应合成氨:N2+3H2?2NH3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为c (N2)=0.1mol/L,c (H2)=0.3mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示.
I.该反应实验②平衡时H2的转化率为
II.据图2所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.③条件:
(4)I.NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的离子方程式是
II.常温下,0.1mol?L-1氨水与0.1mol?L-1盐酸溶液等体积混合(忽略混合后溶液体积的变化),则混合溶液中由水电离出的c(H+)

查看习题详情和答案>>

(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)═CO2(g)+NO(g);△H=-234KJ/mol
NO2(g)+CO(g)═CO2(g)+NO(g);△H=-234KJ/mol
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
| ||
| (一定条件) |
阳极反应式为:3H2-6e-=6H+,则阴极反应式为
N2+6H+=6e-+2NH3
N2+6H+=6e-+2NH3
.(3)工业中常用以下反应合成氨:N2+3H2?2NH3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为c (N2)=0.1mol/L,c (H2)=0.3mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示.
I.该反应实验②平衡时H2的转化率为
40%
40%
.II.据图2所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.③条件:
②与①相比加了催化剂;③与①相比温度升高
②与①相比加了催化剂;③与①相比温度升高
理由:因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以①②两装置达到平衡时N2的浓度相同;
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以①②两装置达到平衡时N2的浓度相同;
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
.该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
(4)I.NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的离子方程式是
NH4++D2O=NH3?HDO+D3O+
NH4++D2O=NH3?HDO+D3O+
.II.常温下,0.1mol?L-1氨水与0.1mol?L-1盐酸溶液等体积混合(忽略混合后溶液体积的变化),则混合溶液中由水电离出的c(H+)
>
>
0.1mol?L-1氨水溶液中由水电离出的c(OH-)(填写“>”“=”或“<”)
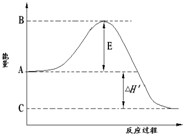 合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:
合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:(1)如图是合成氨时的能量变化图,图中A、C分别表示
(增大、减小、不变).当有
| 1 |
| 3 |
(2)下表是按V(N2):V(H2)=1:3合成氨时NH3的百分含量与压强、温度的统计数据:
| 10 | 20 | 30 | 60 | |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 |
| 500 | 10.6 | 19.1 | 26.4 | 42.0 |
(3)若反应时,反应速率v(N2)为 a mol/L?min,则v(H2)=
(4)在10Pa、400℃时,若以N2(g)与H2(g)的物质的量分别为1mol和3mol进行反应,则达到平衡时,N2(g)的转化率约为
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2.已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式
(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池.请写出该电池的正极反应式
(5)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11.在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va:Vb=
(6)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显
.
查看习题详情和答案>>
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H不改变
不改变
(填“增大”“减小”或“不改变”).(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2.已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1
.(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池.请写出该电池的正极反应式
N2+6e-+8H+=2NH4+
N2+6e-+8H+=2NH4+
.(5)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11.在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va:Vb=
1:10
1:10
.(6)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显
中
中
性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.I已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ?mol-1
CO(g)+
| 1 |
| 2 |
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ?mol-1
则C的燃烧热
II(I)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+C02(g)=2C0(g)
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H20(1)
C.2H20(l)=2H2(g)+02(g)
D.2C0(g)+02(g)=2C02(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,诸写出该原电池的负极反应:
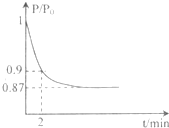
(2)某实验小组模拟工业合成氨反应N2+3H2
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
①反应达平衡的标志是(填字母代号)
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为
③若提高N2的转化率可采取的措施有
A.向体系中按体积比1:1再充入N2和H2 B.分离出NH3
C.升高温度 D.充入He气使压强增大 E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(C
| O | 2- 3 |