网址:http://m.1010jiajiao.com/timu3_id_385448[举报]
常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40 mL,溶液的pH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如右下图所示:
 回答下列问题:
回答下列问题:
(1)在同一溶液中,H2CO3、HCO3-、 CO32- (填:“能”或“不能”)大量共存。
(2)当pH=7时,溶液中各种离子其物质的量浓度的大小关系是: _。
 (3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_ _ ___。
(3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_ _ ___。
(4)若将0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合,则混合后的溶液中c(CO32-) c(HCO3-)((填“大于”、“小于”或“等于”)。溶液中c(OH-)—c(H+)= [用 c(HCO3-)、 c(H2CO3)、c(CO32-)的关系式表示]
查看习题详情和答案>>
常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40 mL,溶液的pH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如右下图所示:
 回答下列问题:
回答下列问题:
(1)在同一溶液中,H2CO3、HCO3-、 CO32- (填:“能”或“不能”)大量共存。
(2)当pH=7时,溶液中各种离子其物质的量浓度的大小关系是: _。
 (3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_ _ ___。
(3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_ _ ___。
(4)若将0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合,则混合后的溶液中c(CO32-) c(HCO3-)((填“大于”、“小于”或“等于”)。溶液中c(OH-)—c(H+)= [用 c(HCO3-)、 c(H2CO3)、c(CO32- )的关系式表示]
查看习题详情和答案>>

(2)实验室可用“双指示剂法”测定碳酸钠、碳酸氢钠混合溶液中各种物质的含量,操作步骤如下:
①取固体样品配成溶液;
②取25mL样品溶液加指示剂A,用0.1010mol/LNaOH标准溶液滴定至终点;
③再加指示剂B,再用0.1010mol/LNaOH标准溶液滴定至终点……
指示剂B的变色范围在pH=______左右最理想。
(3)当pH=7时,此时再滴入盐酸溶液所发生反应离子方程式是____________________。
(4)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=
2︰1时,溶液的pH=_____________。
II.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A
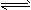 H++HA- HA-
H++HA- HA-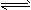 H++A2-
H++A2-已知相同浓度时的电离度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol/L 的H2A溶液
(B)0.01mol/L 的NaHA溶液
(C)0.01mol/L 的HCl与0.04mol/L的NaHA溶液等体积混合液
(D)0.02mol/L 的NaOH与0.02 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号) :
(5)c(H+)最大的是_________,c(H2A)最大的是___________,c(A2-)最大的是_________。
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA的浓度/(mol/L) | NaOH的浓度/(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s) ![]() Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
查看习题详情和答案>>Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA的浓度/(mol/L) | NaOH的浓度/(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s) ![]() Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
查看习题详情和答案>>