网址:http://m.1010jiajiao.com/timu3_id_385244[举报]
A.Q2<Q1<92.4 B.2Q2=Q1=
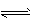 2NH3(g) △H = -92.4 kJ . mol-1。
2NH3(g) △H = -92.4 kJ . mol-1。 (1)在500℃、2.02×107Pa和铁催化条件下,于2L密闭容器中充入1 mol N2和3 mol H2,10 min 时达到平衡,有0.2 mol NH3生成,则10 min内用氮气表示的该反应的平均速率v(N2)为 ___,H2的转化率为___。
(2)充分反应后,放出的热量___(填“<”、“>”或“=”)92.4 kJ,理由是___。
(3)为有效提高氢气的转化率,实际生产中宜采取的措施有__。
A.降低温度
B.不断补充氮气
C.恒容下充入He来增大压强
D.升高温度
E.原料气不断循环
F.及时移出氨
(4)氨催化氧化制NO是在热的铂铑合金催化作用下进行的,反应为4NH3(g)+5O2(g)
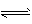 4NO(g)+6H2O(g),反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为 ____,当升高温度时,K值___(填“增大”、“减小”或“不变”)。NH3的转化率在温度T1下随反应时间(t)的变化如图所示。其他条件不变,仅改变温度为T2(T2大于T1),在框图中用虚线画出温度T2下NH3的转化率随反应时间变化的预期结果示意图。
4NO(g)+6H2O(g),反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为 ____,当升高温度时,K值___(填“增大”、“减小”或“不变”)。NH3的转化率在温度T1下随反应时间(t)的变化如图所示。其他条件不变,仅改变温度为T2(T2大于T1),在框图中用虚线画出温度T2下NH3的转化率随反应时间变化的预期结果示意图。 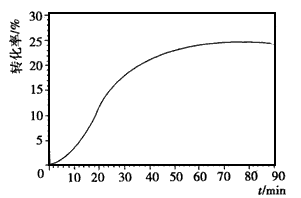
I.已知:反应H2(g) + Cl2(g) = 2HCl(g) ΔH= —184 kJ/mol
4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)
ΔH= —115.6 kJ/mol
2Cl2(g)+2H2O(g)
ΔH= —115.6 kJ/mol


请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ
II.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)已知在400℃时,N2 (g)+ 3H2(g)
 2NH3(g)
△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)(1分)
2NH3(g)
△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)(1分)
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)(1分)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g)
+ D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g)
+ D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
|
t/K |
300 |
400 |
500 |
… |
|
K/(mol·L—1)2 |
4×106 |
8×107 |
K1 |
… |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”) (1分)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。

①放电时,负极的电极反应式为
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为
查看习题详情和答案>>