网址:http://m.1010jiajiao.com/timu3_id_385225[举报]
| 原子序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| E/eV | 13.4 | 24.6 | 5.4 | 9.3 | 8.3 | 11.3 | 14.5 | 13.6 | 17.4 | 21.6 |
| 原子序数 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| E/eV | 5.1 | 7.6 | 6.0 | 8.1 | 11.0 | 10.4 | 13.0 | 15.8 | 4.3 |
(2)同周期内,随着原子序数的递增,E值增大,但个别元素的E值出现反常现象.试预测下列关系正确的是
①E(As)>E(Se) ②E(As)<E(Se) ③E(Br)>E(Se) ④E(Br)<E(Se)
(3)第10号元素E值较大的原因是
(4)第7号元素和第8号元素的E值出现反常的原因
 (2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:(1)查资料得该晶体在110℃可完全失去结晶水.于是将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;恒温在110℃一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:
(2)已知2KMnO4+5H2C2O4+3H2SO4→K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液,取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至浅黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.加入锌粉的目的是
(3)用0.010mol/L KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-被还原成Mn2+.写出发生反应的离子方程式
(4)上述实验滴定时,指示剂应该
(5)在(2)题步骤中,若加入的KMnO4的溶液的量不足,可导致测得的铁含量
(6)重复(2)(3)步骤操作,滴定消耗0.010mol/L KMnO4溶液19.98ml.则实验测得该晶体中铁的质量分数为
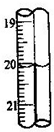
A.20.00mL B.20.0mL C.20.10mL D.20.1mL.
用霞石岩(主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。

溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见图,根据题意回答下列问题:
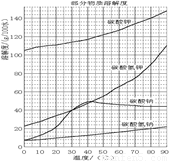
固体M的化学式是__________, X物质是___________。
实验室进行煅烧操作时盛放固体物质的实验仪器是 __________,滤液W中主要含有的离子有__________________。
碳酸化Ⅰ中发生主要反应的离子方程式是_______________________________________。
操作Ⅰ是_________(填写名称),操作Ⅱ是 _______(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
碳酸化Ⅱ调整pH=8的目的是____________________,产品K2CO3中最可能含有的杂质是________(写化学式)。
实验室用下面流程测定产品碳酸钾的纯度,为提高实验精度,T试剂最好是____________;操作Ⅲ的名称是_______________。
查看习题详情和答案>>
(21分)下表是元素周期表的一部分,回答有关问题。
|
| ⅠА | ⅡА | ⅢА | ⅣА | ⅤА | ⅥА | ⅦА | 0 |
| 2 |
|
|
|
| ① |
| ② |
|
| 3 | ③ | ④ | ⑤ | ⑥ |
| ⑦ | ⑧ | ⑨ |
| 4 | ⑩ | 11 |
|
|
|
| 12 |
|
(1)在这些元素中,最活泼的金属元素是(均用元素名称填写) —、最活泼的非金属元素是 、最不活泼的元素是
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写) 、碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间两两相互反应的离子方程式
(3)在这些元素中,原子半径最大的是 —、原子半径最小的是 (均用元素符号填写)
(4)写出②与④形成化合物的电子式 ;写出①单质的电子式 ;
查看习题详情和答案>>