网址:http://m.1010jiajiao.com/timu3_id_385048[举报]
常温下干燥的混合气体可能由H2S、H2、Cl2、SO2、NH3、NO2、NO、CO2和O2中的某几种组成.现进行如下实验:
①混合气体无色,其密度比空气密度大;
②混合气体不能使湿润的品红试纸褪色,打开瓶塞无颜色变化;
③混合气体通过浓硫酸时出现混浊,但气体的体积变化不明显,再通过碱石灰,气体体积缩小到原来的10%;
④上述通过碱石灰的混合气体,若点燃会爆炸,恢复到常温时,剩余气体体积为通过浓硫酸和碱石灰之前的原混合气体的2.5%,若使其通过赤热的铜网,铜网表面变黑.
⑤当原混合气体通过硫酸铜溶液时,剩余气体为原来的90%.
根据以上实验,回答下列问题:
(1)原混合物气体中一定含有________,一定不含有________.
(2)原混合气体的平均摩尔质量为________.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 | O2 | Ar | CO2 |
| -196℃ | -183℃ | -186℃ | -78℃ |
(2)雷雨时空气中的N2转化为NO,生成物NO是
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为
(4)已知:4NH3+6NO
| ||

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为
②为了比较不同催化剂的催化性能,需要测量并记录的数据是
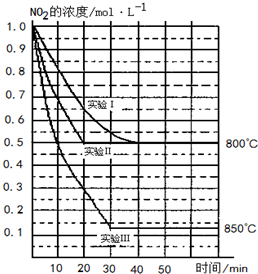 某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)
某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
在2L密闭容器内,800℃时反应:2NO2(g)?2NO(g)+O2(g)体系中,n(NO2)随时间的变化如表:
(1)实验Ⅱ隐含的反应条件是
(2)写出该反应的平衡常数表达式:K=
| c(NO)2×c(O2) |
| c(NO2)2 |
| c(NO)2×c(O2) |
| c(NO2)2 |
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),则平衡将
(4)若将上述第(3)题所得的平衡混和气体通入足量的NaOH溶液中,使气体被充分吸收.生成的产物及其物质的量为
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,该反应的化学方程式为
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将5.60 g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88 g。
①产生的氢气的体积为_________mL(标准状况下)。
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量 mol。
(2)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
Nierite的化学式为___________。T的化学式为____________。
(3)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为______________。
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
|
18K金成分 |
Au |
Ag |
Cu |
|
含量(质量分数) |
75.00% |
_________ |
_________ |
查看习题详情和答案>>
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将5.60 g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88 g。
①产生的氢气的体积为_________mL(标准状况下)。
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量 mol。
(2)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
Nierite的化学式为___________。T的化学式为____________。
(3)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为______________。
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | _________ | _________ |