网址:http://m.1010jiajiao.com/timu3_id_385031[举报]
如图中A、B、C是常见的化学实验装置,请回答下列问题:
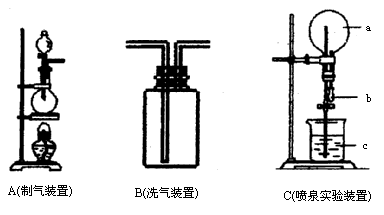
(1)利用A装置,当不加热时,可制取的一种气态单质是________;当加热时,可制取的一种化合物是________.
(2)化学实验室用A装置加热制取氯气,化学方程式为:
________.
为得到纯净、干燥的氯气,可让A中出来的气体在进入收集装置前依次通过分别装有________和________的两个洗气瓶B.
(3)实验室制取氯气和二氧化碳都可用瓶口向上排空集气法收集,具体操作有何不同?为什么?
________
(4)有一烧瓶纯净、干燥的氯气,用装置C做喷泉实验,如何操作才能形成喷泉?
________.
查看习题详情和答案>>下图中A、B、C是常见的化学实验装置,请回答下列问题:

(1)实验里用A装置加热可制取氯气,为得到纯净干燥的氯气,可让A中逸出的气体在进入收集装置前依次通过分别装有________和________的两个洗气瓶B,此时应从B装置中的________(填a或b)口通入气体.
(2)铜在氯气中剧烈燃烧,使集气瓶充满________色的________(填烟或雾),有关化学方程式为________;
(3)为防止氯气尾气污染空气,可用________溶液吸收多余的氯气,原理是(用离子方程式表示)________.
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,工业上生产漂白粉的化学方程________.漂白粉的主要成分是________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体主要是________(用字母代号填).
A.O2
B.Cl2
C.CO2
D.HClO

[实验步骤]
I.按如图所示装置(部分仪器未画出)组装仪器,并检查装置气密性.
Ⅱ.将0.6g炭粉与3.9g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成).
Ⅲ、用酒精灯微微加热试管底部.
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊.请回答:
(1)在图中方框内绘出仪器装置简图,使仪器装置图完整


(2)装置B的作用是
(3)通过探究发现,装置A中发生的反应为2Na2O2+C
| ||


(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种物质.已知反应过程中转移6.02×l023个电子时,生成53g Pd,该反应的化学方程式为
(5)将装置A中充分反应后所得产物溶于适量水中.
①所得溶液的溶质是
②溶液中下列关系正确的是
a、c(Na+)>c(C
| O | 2- 3 |
| O | - 3 |
b、c(Na+)>c(OH-)>c(C
| O | 2- 3 |
| O | - 3 |
c、c(Na+)=2c(C
| O | 2- 3 |
| O | - 3 |
d、c(H+)+c(Na+)=c(OH-)+2c(C
| O | 2- 3 |
| O | - 3 |
③若使所得溶液与100mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为
(15分)Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
[实验步骤]
I、按下图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。
 II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
III. 用酒精灯微微加热试管底部。
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
(1)装置B的作用是 。
(2)通过探究发现,装置A中只发生反应2Na2O2+C Na2CO3+X,则X为 (填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
Na2CO3+X,则X为 (填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
。
②有人认为炭粉的加入量的多少会影响产物X的检验,请简要说明原因:
(3)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd:Mr=106),同时生成另外两种新物质。已知反应过程中转移6.02×1023个电子时,生成53 g Pd,该反应的化学方程式为 。
(4)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①溶液中下列关系正确的是 (填字母序号)。
a.c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c.c(Na+)=2[c(CO32-)+c(HCO3-)+ c(H2CO3)]
d.c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-)
②若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为 。
有趣的化学实验能激发学生学习化学的兴趣,提高学习积极性,同时也活跃课堂气氛。在中学化学教材中,可以挖掘许多有趣的实验,例如:
Ⅰ.[火球游泳]水火不相容,这是人们公认的常识,从来没有看见过火球能在水面上游来游去。然而,某化学兴趣小组的同学,做了一个“火球游泳”小魔术。他在一个100毫升的烧杯里面装上自来水,然后用镊子将一块豆粒大的金属钾,轻轻地放在烧杯里,这时,烧杯里的水面上立刻生成个火球,这个火球在水面上滚来滚去,同时发生嗤嗤的响声,场景十分壮观。
Ⅱ.[“蓝瓶子”实验]在250 mL平底烧瓶中依次加入2 g氢氧化钠、100 mL蒸馏水、2 g葡萄糖(粉末),振荡使其溶解。滴入4~6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色消失,变为无色。再次振荡,无色溶液又呈蓝色。可反复多次。已知:亚甲基蓝容易被还原。根据上述实验,回答下列问题:
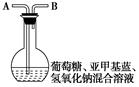
(1)实验室中金属钾应保存在______________________,原因是________________________________;化学兴趣小组的同学取出一小粒金属钾的操作是________________________________________________________________________
________________________________________________________________________。
(2)写出Ⅰ中金属钾发生反应的离子方程式: __________________________________
________________________________________________________________________。
(3)为探究“蓝瓶子”实验是什么原因引起的,某同学做了以下实验:
A.从烧瓶中取出溶液注满一支试管,塞上橡皮塞。试管中的溶液由蓝色变为无色,再振荡试管溶液不能变蓝。
B.在原烧瓶中经A处鼓入空气,溶液又慢慢变蓝了。静置片刻后,蓝色又消失。再次鼓入空气,又慢慢变蓝。
C.为了进一步弄清是何种成分引起的,他又继续探索。从A处改通纯净的N2、CO2,都不能使烧瓶中的无色溶液变蓝。把制得的氧气从A处通入,发现上述无色溶液慢慢变为蓝色。
到此为止,“蓝瓶子”实验原理有了科学结论,请你总结“蓝瓶子”实验的变色原理:________________________________________________________________________
________________________________________________________________________。
查看习题详情和答案>>