题目内容
工业上利用反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=Q kJ·mol―1,制备H2 。已知该反应的平衡常数K与温度的关系如图所示。
CO2(g)+H2(g) △H=Q kJ·mol―1,制备H2 。已知该反应的平衡常数K与温度的关系如图所示。

若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系
如下表:
| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q 0(填“>”、“=”或“<”)。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”)。
(4)达平衡时CO2的反应速率 ,CO(g)的转化率为 。
(10分)
(1)C(2分) (2)< (2分)(3)不变 (2分)
(4)0.04 mol·L―1 ·min―1 60% (各2分)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案工业上利用反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);△H=Q kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。
CO2(g)+H2(g);△H=Q kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。
若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是_______.
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q______0(填“>”、“=”或“<”).
(3)若在850℃时向反应容器中充入H2O(g),K值_____(填“增大”、“减小”或“不变”).
(4)达平衡时CO2的反应速率______,CO(g)的转化率为_______.
工业上利用反应:CO(g)+H2O(g)  CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。
CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。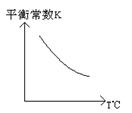
若在一容积固定的密 闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是_______.
A.单
 位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
位时间内减少CO(g)的浓度等于生成CO2(g)的浓度B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q______0(填“>”、“=”或“<”).
(3)若在850℃时向反应容器中充入H2O(g),K值___
 __(填“增大”、“减小”或“不变”).
__(填“增大”、“减小”或“不变”). (4)达平衡时CO2的反应速率______,CO(g)的转化率为_______.
工业上利用反应:CO(g)+H2O(g)
 CO2(g)+H2(g);△H=Q kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。
CO2(g)+H2(g);△H=Q kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。

若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
|
t/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c4 |
|
4 |
c1 |
c2 |
c3 |
c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是_______.
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q______0(填“>”、“=”或“<”).
(3)若在850℃时向反应容器中充入H2O(g),K值_____(填“增大”、“减小”或“不变”).
(4)达平衡时CO2的反应速率______,CO(g)的转化率为_______.
