摘要:19.铍是金属中最好的良导体.因它有极好的吸热.散热性能.故有许多超音速飞机的制动装置是用铍来制造的.当人造地球卫星和宇宙飞船穿上铍的“防热外套 时.能够及时吸收因穿越大气层摩擦而产生的热量并很快散发出去.从而保障飞船的飞行安全. 铍还是高效率的火箭燃料.铍在燃烧时能释放出巨大的能量:每1kg的铍完全燃烧放出的热量为62700kJ.另外.几乎各种各样的原子反应堆都要用铍做中子反射体.要建设一个大型的原子反应堆.往往需要动用2吨金属铍. 根据上述信息.请回答下列问题: ①试写出铍燃烧的热化学反应方程式: . ②氧化铍.氢氧化铍性质类似于氧化铝.氢氧化铝.则氧化铍为 氧化物(填“酸性 或“碱性 或“两性 ). ③如果氢氧化铍与碱反应生成的阴离子中铍原子最外层电子数满足8电子结构.试写出氢氧化铍与氢氧化钠溶液反应的化学反应方程式: . ④写出氧化铍与盐酸反应的离子反应方程式: . ⑤能有效除去水中铍离子的试剂是: . A.氨水 B.碳酸钠溶液 C.稀硫酸 D.氢氧化钠溶液
网址:http://m.1010jiajiao.com/timu3_id_384837[举报]
某同学查阅资料后发现对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸B.稀硫酸 C.稀硝酸 D.NaOH溶液.
查看习题详情和答案>>
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2050 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
合理
合理
(填“合理”或“不合理”);(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
NaOH溶液
NaOH溶液
,反应的离子方程式2Al+2OH-+H2O=2AlO2-+3H2↑
2Al+2OH-+H2O=2AlO2-+3H2↑
;(3)实验室溶解该熔融物,下列试剂中最好的是
B
B
(填序号).A.浓硫酸B.稀硫酸 C.稀硝酸 D.NaOH溶液.
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.则B点对应的沉淀的物质的量为
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:
(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
反应的离子方程式为 .
(3)实验室溶解该熔融物,下列试剂中最好的是 (填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
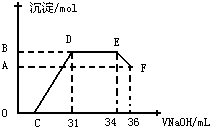
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 上述现象说明溶液中 结合OH-的能力比 强(填离子符号).
(3)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
查看习题详情和答案>>
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
反应的离子方程式为
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
(3)B点对应的沉淀的物质的量为
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Ⅰ.(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理: ( 填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,反应的离子方程式为 .
(3)实验室溶解该熔融物,下列试剂中最好的是 (填序号),并说明理由: .
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)逐滴加入4mol/L的氢氧化钠溶液的定量玻璃仪器 ,图中OC段没有沉淀生成的原因是: .(用离子方程式表示)
(2)由上述图形分析可知,溶液中结合OH-能力最强的离子是 (填离子符号,下同)、最弱的离子是 .若测定F点沉淀的质量,需对混合物进行:过滤、 、 、称量.
(3)通过如图数据试计算,熔融物中两种金属的物质的量之比n(Fe):n(Al)= .
查看习题详情和答案>>
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | --- |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液

Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)逐滴加入4mol/L的氢氧化钠溶液的定量玻璃仪器
(2)由上述图形分析可知,溶液中结合OH-能力最强的离子是
(3)通过如图数据试计算,熔融物中两种金属的物质的量之比n(Fe):n(Al)=
 NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑
3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑
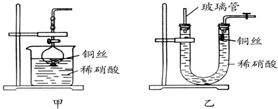
.(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示.
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是
2NO+O2═2NO2
2NO+O2═2NO2
(写化学方程式).(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO.反应开始时,可以在U形管右端观察到无色的NO气体.长玻璃管的作用是
接收被气体压出U形管的液体,防止稀硝酸溢出
接收被气体压出U形管的液体,防止稀硝酸溢出
.(4)假设实验中12.8g Cu全部溶解,需要通入标准状况下
2.24
2.24
L O2才能使NO全部溶于水.(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是
丁
丁
(填“甲”“乙”“丙”或“丁”),理由是制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体
制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体
.甲:铜
| 浓硝酸 |
乙:铜
| 稀硝酸 |
丙:铜
| 氯气 |
| 硝酸 |
丁:铜
| 空气 |
| 硝酸 |