题目内容
 NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑
3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑
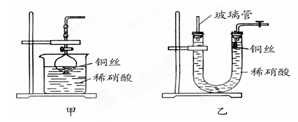
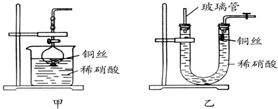
.(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示.
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是
2NO+O2═2NO2
2NO+O2═2NO2
(写化学方程式).(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO.反应开始时,可以在U形管右端观察到无色的NO气体.长玻璃管的作用是
接收被气体压出U形管的液体,防止稀硝酸溢出
接收被气体压出U形管的液体,防止稀硝酸溢出
.(4)假设实验中12.8g Cu全部溶解,需要通入标准状况下
2.24
2.24
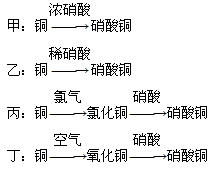
L O2才能使NO全部溶于水.(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是
丁
丁
(填“甲”“乙”“丙”或“丁”),理由是制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体
制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体
.甲:铜
| 浓硝酸 |
乙:铜
| 稀硝酸 |
丙:铜
| 氯气 |
| 硝酸 |
丁:铜
| 空气 |
| 硝酸 |
分析:(1)根据铜的还原性和硝酸的氧化性,写出化学反应方程式,根据方程式书写离子反应方程式;
(2)二氧化氮是红棕色的气体,一氧化氮很容易和空气中的氧气化合,生成红棕色的二氧化氮气体;
(3)根据一氧化氮的溶解性和装置的特点解答;
(4)根据得失电子守恒解答,1个铜原子失去2个电子,1个氧分子得到4个电子变成-2价的氧;
(5)从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不对环境造成污染;
(2)二氧化氮是红棕色的气体,一氧化氮很容易和空气中的氧气化合,生成红棕色的二氧化氮气体;
(3)根据一氧化氮的溶解性和装置的特点解答;
(4)根据得失电子守恒解答,1个铜原子失去2个电子,1个氧分子得到4个电子变成-2价的氧;
(5)从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不对环境造成污染;
解答:解:(1)硝酸具有氧化性,能氧化金属,铜和硝酸反应,铜从0价变为+2价,变成硝酸铜,硝酸中的+5价的氮被还原成一氧化氮,反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)一氧化氮很容易和空气中的氧气化合,生成红棕色的二氧化氮气体,所以,制取一氧化氮的装置打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,发生2NO+O2═2NO2,
故答案为:2NO+O2═2NO2;
(3)一氧化氮是难溶于水的气体,当取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出,
故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
(4)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气和水反应生成硝酸,4NO+2H2O+3O2=4HNO3,氧气得电子,一氧化氮失去电子,所以铜失去的电子数等于氧气得到的电子数,12.8g Cu为 0.2mol,全部溶解,失去0.4mol电子,1个氧分子得到4个电子变成-2价的氧,所以需氧气0.1mol,0.1mol氧气在标准状况下的体积为2.24 L,
故答案为:2.24 L;
(5)甲:铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,不环保,故甲不正确;
乙:铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,不环保,故乙不正确;
丙:此过程中使用到了氯气,氯气剧毒,对环保不利,且氯化铜不能与硝酸反应生成硝酸铜,故丙不正确;
丁:此过程用方程式可表示为:2Cu+O2
2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料,故丁正确;
故答案为:丁;制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体;
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)一氧化氮很容易和空气中的氧气化合,生成红棕色的二氧化氮气体,所以,制取一氧化氮的装置打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,发生2NO+O2═2NO2,
故答案为:2NO+O2═2NO2;
(3)一氧化氮是难溶于水的气体,当取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出,
故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
(4)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气和水反应生成硝酸,4NO+2H2O+3O2=4HNO3,氧气得电子,一氧化氮失去电子,所以铜失去的电子数等于氧气得到的电子数,12.8g Cu为 0.2mol,全部溶解,失去0.4mol电子,1个氧分子得到4个电子变成-2价的氧,所以需氧气0.1mol,0.1mol氧气在标准状况下的体积为2.24 L,
故答案为:2.24 L;
(5)甲:铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,不环保,故甲不正确;
乙:铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,不环保,故乙不正确;
丙:此过程中使用到了氯气,氯气剧毒,对环保不利,且氯化铜不能与硝酸反应生成硝酸铜,故丙不正确;
丁:此过程用方程式可表示为:2Cu+O2
| ||
故答案为:丁;制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体;
点评:本题考查了铜与硝酸的反应,掌握相关的化学反应方程式是解答本题的关键,题目难度中等.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
(8分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的 调控。
调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
___________________________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯 装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。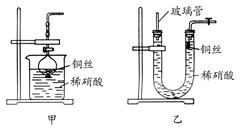
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)
| A.铁 | B.铝 |
| C.铂 | D.玻璃 |
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。
长玻璃管的作用是_______________________________________。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准
 状况下________mL O2才能使NO全部溶于水。
状况下________mL O2才能使NO全部溶于水。 
 NO很容易与许多分子迅速发生反应,科学家发现在生命体中会不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
NO很容易与许多分子迅速发生反应,科学家发现在生命体中会不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.