网址:http://m.1010jiajiao.com/timu3_id_38458[举报]
(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为
(2)该系列中的N2H4是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染.已知40g N2H4在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:
(3)该系列物中的NH3对农业、化学、国防工业具有重要意义.其合成原理为:
N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1
Ⅰ.在一定温度下,将1.5molN2和6molH2通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则此时反应放出的热量为
该温度下合成氨反应的平衡常数K1=
Ⅱ.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN2、bmolH2、cmolNH3,平衡时
NH3的物质的量分数为25%,则:达到平衡时,Ⅰ和Ⅱ放出的热量
A.一定相等
B.前者一定小于后者
C.前者等于或小于后者
D.前者等于或大于后者
Ⅰ和Ⅱ合成氨的平衡常数分别为K1和K2,同K1
欲使开始时反应正向进行,a的取值范围为
在元素周期表中处于相邻位置的元素在结构和性质上有许多相似的地方。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H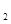 O外,还有H
O外,还有H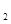 O
O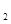 ;碳元素的氢化物除CH
;碳元素的氢化物除CH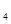 外,还有C
外,还有C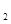 H
H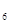 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N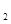 H
H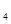 等。
等。
(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的N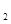 H
H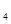 是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N
是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N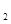 H
H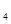 在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:
。
在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:
。
(3)该系列物中的NH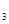 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为:
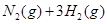


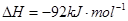
I.在一定温度下,将1.5molN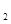 和6 molH
和6 molH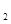 通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
此时反应放出的热量为 kJ.
H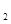 的转化率= 。
的转化率= 。
该温度下合成氨反应的平衡常数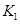 =
(只列数字表达式)
=
(只列数字表达式)
II.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN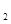 、bmolH
、bmolH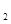 、cmolNH
、cmolNH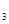 ,平衡时NH
,平衡时NH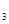 的物质的量分数为25%,则:
的物质的量分数为25%,则:
达到平衡时,I和II放出的热量 (填字母代号)
A。一定相等
B。前者一定小于后者
C。前者等于或小于后者
D。前者等于或大于后者
I和II合成氨的平衡常数分别为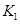 和
和 ,同
,同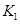
 (填“﹥”、“﹤”或
“=”)
(填“﹥”、“﹤”或
“=”)
欲使开始时反应正向进行,a的取值范围为 。
查看习题详情和答案>>
在元素周期表中处于相邻位置的元素在结构和性质上有许多相似的地方。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H![]() O外,还有H
O外,还有H![]() O
O![]() ;碳元素的氢化物除CH
;碳元素的氢化物除CH![]() 外,还有C
外,还有C![]() H
H![]() 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N![]() H
H![]() 等。
等。
(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的N![]() H
H![]() 是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N
是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N H
H![]() 在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式: 。
在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式: 。
(3)该系列物中的NH![]() 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为:
![]()
![]()
![]()
I.在一定温度下,将1.5molN 和6 molH
和6 molH![]() 通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
此时反应放出的热量为 kJ.
H![]() 的转化率= 。
的转化率= 。
该温度下合成氨反应的平衡常数![]() = (只列数字表达式)
= (只列数字表达式)
II.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN 、bmolH
、bmolH![]() 、cmolNH
、cmolNH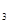 ,平衡时NH
,平衡时NH![]() 的物质的量分数为25%,则:
的物质的量分数为25%,则:
达到平衡时,I和II放出的热量 (填字母代号)
A。一定相等
B。前者一定小于后者
C。前者等于或小于后者
D。前者等于或大于后者
I和II合成氨的平衡常数分别为![]() 和
和![]() ,同
,同![]()
![]() (填“﹥”、“﹤”或“=”)
(填“﹥”、“﹤”或“=”)
欲使开始时反应正向进行,a的取值范围为 。
查看习题详情和答案>>
在元素周期表中处于相邻位置的元素在结构和性质上有许多相似的地方。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H O外,还有H
O外,还有H O
O ;碳元素的氢化物除CH
;碳元素的氢化物除CH 外,还有C
外,还有C H
H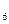 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N H
H 等。
等。
(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的N H
H 是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N
是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N H
H 在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式: 。
在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式: 。
(3)该系列物中的NH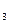 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为: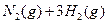


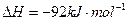
I.在一定温度下,将1.5molN 和6 molH
和6 molH 通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
此时反应放出的热量为 kJ.
H 的转化率= 。
的转化率= 。
该温度下合成氨反应的平衡常数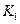 = (只列数字表达式)
= (只列数字表达式)
II.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN 、bmolH
、bmolH 、cmolNH
、cmolNH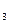 ,平衡时NH
,平衡时NH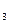 的物质的量分数为25%,则:
的物质的量分数为25%,则:
达到平衡时,I和II放出的热量 (填字母代号)
| A.一定相等 |
| B.前者一定小于后者 |
| C.前者等于或小于后者 |
| D.前者等于或大于后者 |
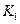 和
和 ,同
,同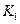
 (填“﹥”、“﹤
(填“﹥”、“﹤ ”或
”或 “=”)
“=”)欲使开始时反应正向进行,a的取值范围为 。 查看习题详情和答案>>
 O外,还有H
O外,还有H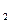 O
O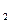 ;碳元素的氢化物除CH
;碳元素的氢化物除CH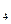 外,还有C
外,还有C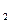 H
H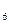 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N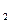 H
H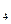 等。
等。(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的N
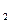 H
H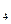 是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N
是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N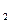 H
H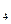 在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式: 。
在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式: 。(3)该系列物中的NH
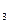 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为: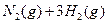

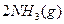
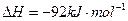
I.在一定温度下,将1.5molN
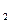 和6 molH
和6 molH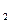 通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则此时反应放出的热量为 kJ.
H
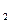 的转化率= 。
的转化率= 。该温度下合成氨反应的平衡常数
 = (只列数字表达式)
= (只列数字表达式)II.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN
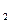 、bmolH
、bmolH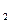 、cmolNH
、cmolNH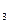 ,平衡时NH
,平衡时NH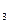 的物质的量分数为25%,则:
的物质的量分数为25%,则:达到平衡时,I和II放出的热量 (填字母代号)
| A.一定相等 |
| B.前者一定小于后者 |
| C.前者等于或小于后者 |
| D.前者等于或大于后者 |
 和
和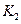 ,同
,同
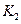 (填“﹥”、“﹤
(填“﹥”、“﹤ ”或
”或 “=”)
“=”)欲使开始时反应正向进行,a的取值范围为 。