摘要:9.盛NaOH溶液的试剂瓶.倾倒过溶液后.瓶中残留的液体过一段时间变成白色固体.该物质是 A.NaOH B.Na2O C.Na2CO3 D.NaHCO3
网址:http://m.1010jiajiao.com/timu3_id_382146[举报]
 某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题(1)现有仪器:托盘天平、药匙、烧杯、胶头滴管,还需要哪些玻璃仪器才能完成该实验?请写出
250mL容量瓶、玻璃棒
250mL容量瓶、玻璃棒
.(2)请写出该实验简要的实验步骤:
①计算 ②称量胆矾
25.0
25.0
g ③溶解 ④转移 ⑤洗涤并转移⑥定容 ⑦摇匀(3)如图是该同学转移溶液的示意图,图中的错误是
转移溶液时不能直接倾倒,应用玻璃棒引流
转移溶液时不能直接倾倒,应用玻璃棒引流
.(4)该同学在定容后,加盖倒转摇匀,发现液面低于刻度线,又滴加蒸馏水至刻度.则该同学配得的溶液浓度
偏低
偏低
(填“偏高”、“偏低”或“准确”).(5)一瓶配制好的稀CuSO4溶液,因时间过长,标签污损,为检验它就是盛有CuSO4溶液,说说你的实验检验方法.
| 鉴别对象 | 所选试剂 | 反应的离子方程式 |
| Cu2+ | NaOH溶液 NaOH溶液 |
Cu2++2OH-=Cu(OH)2↓ Cu2++2OH-=Cu(OH)2↓ |
| SO42- | 稀盐酸,BaCl2溶液 稀盐酸,BaCl2溶液 |
Ba2++SO42-=BaSO4↓ Ba2++SO42-=BaSO4↓ |
水合肼是一种重要的精细化工原料,纯品为无色透明的油状液体,在高温下分解成N2、NH3和H2.水合肼具有还原性,能与碘反应:N2H4+2I2═N2+4HI.在农药、医药及有机合成中有广泛用途.用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→N2H4?H2O+NaCl+Na2CO3
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2.静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液.
步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h.
步骤3.将步骤2所得溶液,转移到三口烧瓶(见图甲)并加入5gKMnO4作催化剂,边搅拌边急速升温,在108℃回流5min.
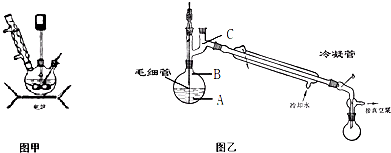
(1)步骤1中检测NaClO浓度的目的是______.步骤2中冰水浴的作用是______.
(2)粗产品倒入图乙的烧瓶中进行减压蒸馏.减压蒸馏的原理是______.在烧瓶中插入一根毛细管,通过蒸馏即可得到纯品.在减压蒸馏过程中毛细管的作用是______,温度计水银球放置的位置是______(填写图中A、B、C).
(3)测定水合肼的质量分数可采用下列步骤:
a.准确称取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液.
b.移取10.00mL于锥形瓶中,加入20mL水,摇匀.
c.用0.1000mol?L-1碘的标准溶液滴定至溶液出现微黄色且0.5min内不消失,记录消耗溶液的体积.
d.进一步操作与数据处理
①使用容量瓶前要先检漏并洗净,检漏的操作方法是______.
②滴定时,碘的标准溶液盛放在______滴定管中(填“酸式”或“碱式”);称取1.250g试样时所用的仪器是______.
③若本次滴定消耗碘的标准溶液为18.00mL,则产品中N2H4?H2O的质量分数为______.
④为获得更精确的滴定结果,步骤d中进一步的操作是______.
查看习题详情和答案>>
水合肼是一种重要的精细化工原料,纯品为无色透明的油状液体,在高温下分解成N2、NH3和H2.水合肼具有还原性,能与碘反应:N2H4+2I2═N2+4HI.在农药、医药及有机合成中有广泛用途.用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→N2H4?H2O+NaCl+Na2CO3
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2.静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液.
步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h.
步骤3.将步骤2所得溶液,转移到三口烧瓶(见图甲)并加入5gKMnO4作催化剂,边搅拌边急速升温,在108℃回流5min.

(1)步骤1中检测NaClO浓度的目的是______.步骤2中冰水浴的作用是______.
(2)粗产品倒入图乙的烧瓶中进行减压蒸馏.减压蒸馏的原理是______.在烧瓶中插入一根毛细管,通过蒸馏即可得到纯品.在减压蒸馏过程中毛细管的作用是______,温度计水银球放置的位置是______(填写图中A、B、C).
(3)测定水合肼的质量分数可采用下列步骤:
a.准确称取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液.
b.移取10.00mL于锥形瓶中,加入20mL水,摇匀.
c.用0.1000mol?L-1碘的标准溶液滴定至溶液出现微黄色且0.5min内不消失,记录消耗溶液的体积.
d.进一步操作与数据处理
①使用容量瓶前要先检漏并洗净,检漏的操作方法是______.
②滴定时,碘的标准溶液盛放在______滴定管中(填“酸式”或“碱式”);称取1.250g试样时所用的仪器是______.
③若本次滴定消耗碘的标准溶液为18.00mL,则产品中N2H4?H2O的质量分数为______.
④为获得更精确的滴定结果,步骤d中进一步的操作是______.
查看习题详情和答案>>
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2.静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液.
步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h.
步骤3.将步骤2所得溶液,转移到三口烧瓶(见图甲)并加入5gKMnO4作催化剂,边搅拌边急速升温,在108℃回流5min.

(1)步骤1中检测NaClO浓度的目的是______.步骤2中冰水浴的作用是______.
(2)粗产品倒入图乙的烧瓶中进行减压蒸馏.减压蒸馏的原理是______.在烧瓶中插入一根毛细管,通过蒸馏即可得到纯品.在减压蒸馏过程中毛细管的作用是______,温度计水银球放置的位置是______(填写图中A、B、C).
(3)测定水合肼的质量分数可采用下列步骤:
a.准确称取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液.
b.移取10.00mL于锥形瓶中,加入20mL水,摇匀.
c.用0.1000mol?L-1碘的标准溶液滴定至溶液出现微黄色且0.5min内不消失,记录消耗溶液的体积.
d.进一步操作与数据处理
①使用容量瓶前要先检漏并洗净,检漏的操作方法是______.
②滴定时,碘的标准溶液盛放在______滴定管中(填“酸式”或“碱式”);称取1.250g试样时所用的仪器是______.
③若本次滴定消耗碘的标准溶液为18.00mL,则产品中N2H4?H2O的质量分数为______.
④为获得更精确的滴定结果,步骤d中进一步的操作是______.
查看习题详情和答案>>
(2013?湖州二模)水合肼是一种重要的精细化工原料,纯品为无色透明的油状液体,在高温下分解成N2、NH3和H2.水合肼具有还原性,能与碘反应:N2H4+2I2═N2+4HI.在农药、医药及有机合成中有广泛用途.用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→N2H4?H2O+NaCl+Na2CO3
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2.静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液.
步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h.
步骤3.将步骤2所得溶液,转移到三口烧瓶(见图甲)并加入5gKMnO4作催化剂,边搅拌边急速升温,在108℃回流5min.
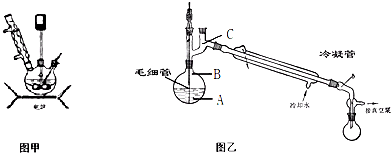
(1)步骤1中检测NaClO浓度的目的是
(2)粗产品倒入图乙的烧瓶中进行减压蒸馏.减压蒸馏的原理是
(3)测定水合肼的质量分数可采用下列步骤:
a.准确称取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液.
b.移取10.00mL于锥形瓶中,加入20mL水,摇匀.
c.用0.1000mol?L-1碘的标准溶液滴定至溶液出现微黄色且0.5min内不消失,记录消耗溶液的体积.
d.进一步操作与数据处理
①使用容量瓶前要先检漏并洗净,检漏的操作方法是
②滴定时,碘的标准溶液盛放在
③若本次滴定消耗碘的标准溶液为18.00mL,则产品中N2H4?H2O的质量分数为
④为获得更精确的滴定结果,步骤d中进一步的操作是
查看习题详情和答案>>
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2.静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液.
步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h.
步骤3.将步骤2所得溶液,转移到三口烧瓶(见图甲)并加入5gKMnO4作催化剂,边搅拌边急速升温,在108℃回流5min.

(1)步骤1中检测NaClO浓度的目的是
确定所需尿素与NaOH的用量
确定所需尿素与NaOH的用量
.步骤2中冰水浴的作用是减少副反应的发生
减少副反应的发生
.(2)粗产品倒入图乙的烧瓶中进行减压蒸馏.减压蒸馏的原理是
通过减小体系压强,可以使液体在较低温度下沸腾
通过减小体系压强,可以使液体在较低温度下沸腾
.在烧瓶中插入一根毛细管,通过蒸馏即可得到纯品.在减压蒸馏过程中毛细管的作用是防止暴沸
防止暴沸
,温度计水银球放置的位置是C
C
(填写图中A、B、C).(3)测定水合肼的质量分数可采用下列步骤:
a.准确称取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液.
b.移取10.00mL于锥形瓶中,加入20mL水,摇匀.
c.用0.1000mol?L-1碘的标准溶液滴定至溶液出现微黄色且0.5min内不消失,记录消耗溶液的体积.
d.进一步操作与数据处理
①使用容量瓶前要先检漏并洗净,检漏的操作方法是
在容量瓶中注入适量水,塞上瓶塞,食指顶住瓶塞,另一只手托住瓶底,倒立过来,观察是否漏水,若不漏水,将瓶正立并将瓶塞旋转180°后,再次检验
在容量瓶中注入适量水,塞上瓶塞,食指顶住瓶塞,另一只手托住瓶底,倒立过来,观察是否漏水,若不漏水,将瓶正立并将瓶塞旋转180°后,再次检验
.②滴定时,碘的标准溶液盛放在
酸式
酸式
滴定管中(填“酸式”或“碱式”);称取1.250g试样时所用的仪器是电子天平
电子天平
.③若本次滴定消耗碘的标准溶液为18.00mL,则产品中N2H4?H2O的质量分数为
90%
90%
.④为获得更精确的滴定结果,步骤d中进一步的操作是
重复步骤b和c1~2次
重复步骤b和c1~2次
.