摘要:26.已知NaCl晶胞的结构如图. 经X射线衍射测得晶体中Na+与Cl-平均距离为acm.利用上述信息和数据.有一简单可行的测定阿伏加德罗常数(NA)方法.具体步骤如下: ①将固体食盐研碎.干燥后.准确称取mgNaCl固体.并加入定容仪器A中. ②用滴定管向仪器A中加苯.并不断振荡.继续加苯至A仪器的刻度线.计算出NaCl固的体积为VmL.回答下列问题: (1)步骤①中A仪器最好用 . (2)能否用胶头滴管代替步骤②中的滴定管? .原因是 . (3)利用上述方法测得的阿伏加德罗常数表达式为NA= .
网址:http://m.1010jiajiao.com/timu3_id_381930[举报]
(2012?大兴区一模)电子仪表部件常用的一种高分子材料DAP的结构简式为: ,X为未知部分的结构,各物质间有如下转化:
,X为未知部分的结构,各物质间有如下转化:

试根据下列信息回答相关问题:
已知:

(1)A是一种脂肪烃,A生成B的反应类型是
(2)B的官能团的名称是
(3)D的分子式是C8H8O3,分子内所有碳原子共平面,D在一定条件下可以生成五元环酯,其结构简式是
 .
.
(4)E发生银镜反应的化学方程式是
 .
.
(5)写出DAP单体的结构简式

(6)F有多种同分异构体.符合下列要求的同分异构体共有

①属于芳香族化合物 ②能发生银镜反应 ③核磁共振氢谱显示苯环上只有一种氢
(7)G在一定条件下合成高分子化合物N的化学方程式是
 .
.
查看习题详情和答案>>
 ,X为未知部分的结构,各物质间有如下转化:
,X为未知部分的结构,各物质间有如下转化:
试根据下列信息回答相关问题:
已知:

(1)A是一种脂肪烃,A生成B的反应类型是
取代反应
取代反应
.(2)B的官能团的名称是
碳碳双键和氯原子
碳碳双键和氯原子
,B生成C的化学反应方程式是CH2=CH-CH2Cl+NaOH
CH2=CH-CH2OH+NaCl
| H2O |
CH2=CH-CH2Cl+NaOH
CH2=CH-CH2OH+NaCl
.| H2O |
(3)D的分子式是C8H8O3,分子内所有碳原子共平面,D在一定条件下可以生成五元环酯,其结构简式是


(4)E发生银镜反应的化学方程式是


(5)写出DAP单体的结构简式


(6)F有多种同分异构体.符合下列要求的同分异构体共有
7
7
种,写出其中任意2种:

①属于芳香族化合物 ②能发生银镜反应 ③核磁共振氢谱显示苯环上只有一种氢
(7)G在一定条件下合成高分子化合物N的化学方程式是


某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:
①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3:1.②ROOCCH2COOR′+CH2=CHCOOR″
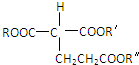
(R、R′、R″代表相同或不相同的烃基)
(1)A分子中的含氧官能团的名称是
(2)D→E反应的化学方程式是
(3)A→B反应所需的试剂是
(4)G→H反应的化学方程式是
(5)已知1mol E 与2mol J 反应生成1mol M,则M的结构简式是
 .
.
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有 等
等 等.
等.
(7)J 可合成高分子化合物,该高分子化合物结构简式是
 .
.
查看习题详情和答案>>

已知:
①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3:1.②ROOCCH2COOR′+CH2=CHCOOR″
| 乙醇 |
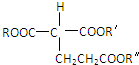
(R、R′、R″代表相同或不相同的烃基)
(1)A分子中的含氧官能团的名称是
羟基
羟基
.(2)D→E反应的化学方程式是
HOOCCH2COOH+2CH3OH
CH3OOCCH2COOCH3+2H2O
| 浓硫酸 |
| △ |
HOOCCH2COOH+2CH3OH
CH3OOCCH2COOCH3+2H2O
.| 浓硫酸 |
| △ |
(3)A→B反应所需的试剂是
NaOH水溶液、加热
NaOH水溶液、加热
.(4)G→H反应的化学方程式是
ClCH2CH2COOH+2NaOH
CH2=CHCOONa+NaCl+2H2O
| 醇 |
| △ |
ClCH2CH2COOH+2NaOH
CH2=CHCOONa+NaCl+2H2O
.| 醇 |
| △ |
(5)已知1mol E 与2mol J 反应生成1mol M,则M的结构简式是


(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有
5
5
种,其中任意1种的结构简式是 等
等 等
等(7)J 可合成高分子化合物,该高分子化合物结构简式是


聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原成Fe2+.实验步骤如下:
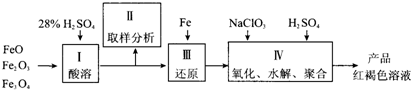
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 .
A.容量瓶;B.烧杯;C.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是 .
A.控制溶液中Fe2+与Fe3+含量比; B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量; D.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用硝酸氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+2NO↑+4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊.利是 ,弊是 .
聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比.
(4)测定时所需的试剂 .
A.NaOH; B.FeSO4 ;C.BaCl2 ;D.NaClO3
(5)需要测定 和 的质量(填写化合物的化学式).
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出).
A.萃取、分液 B.过滤、洗涤
C.蒸发、结品 D.冷却、称量 E.烘干或灼烧.
查看习题详情和答案>>

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
A.容量瓶;B.烧杯;C.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
A.控制溶液中Fe2+与Fe3+含量比; B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量; D.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用硝酸氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+2NO↑+4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊.利是
聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比.
(4)测定时所需的试剂
A.NaOH; B.FeSO4 ;C.BaCl2 ;D.NaClO3
(5)需要测定
(6)选出测定过程中所需的基本操作
A.萃取、分液 B.过滤、洗涤
C.蒸发、结品 D.冷却、称量 E.烘干或灼烧.
以对甲酚(A)为起始原料,通过一系列反应合成有机物E的合成路线如下:

(1)A→B的反应类型为 .
(2)C的核磁共振氢谱有 个峰.
(3)D→E的反应中还生成了NaCl,则X的化学式为 .
(4)写出同时满足下列条件的D的同分异构体的结构简式: (任写一种).
①苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种
②与Na2CO3溶液反应放出气体
(5)已知:R-CN
R-COOH,E在酸性条件下水解后的产物在一定条件下可生成F(C11H10O3).写出F的结构简式: .
(6)写出以对甲酚和乙醇为主要原料制备 的合成路线流程图,(无机试剂任用).流程图示例如下:
的合成路线流程图,(无机试剂任用).流程图示例如下:
查看习题详情和答案>>

(1)A→B的反应类型为
(2)C的核磁共振氢谱有
(3)D→E的反应中还生成了NaCl,则X的化学式为
(4)写出同时满足下列条件的D的同分异构体的结构简式:
①苯的衍生物,苯环上有四个取代基且苯环上的一取代产物只有一种
②与Na2CO3溶液反应放出气体
(5)已知:R-CN
| H+ | H2O |
(6)写出以对甲酚和乙醇为主要原料制备
 的合成路线流程图,(无机试剂任用).流程图示例如下:
的合成路线流程图,(无机试剂任用).流程图示例如下: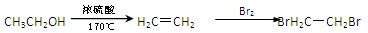
(2009?上海)尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出了两条合成路线).
已知:R-Cl
R-CN
R-CH2NH2
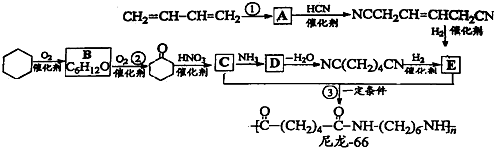
完成下列填空:
(1)写出反应类型:反应②
(2)写出化合物D的结构简式:
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:
 ;
;
(4)写出反应①的化学方程式:
(5)下列化合物中能与E发生化学反应的是
a.NaOH b.Na2CO3 c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):
 .
.
查看习题详情和答案>>
已知:R-Cl
| HCN |
| 催化剂 |
| H2 |
| 催化剂 |

完成下列填空:
(1)写出反应类型:反应②
氧化反应
氧化反应
,反应③缩聚反应
缩聚反应
;(2)写出化合物D的结构简式:
NH4OOC(CH2)4COONH4
NH4OOC(CH2)4COONH4
;(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:


(4)写出反应①的化学方程式:
CH2=CH-CH=CH2+Cl2→CH2ClCH=CHCH2Cl
CH2=CH-CH=CH2+Cl2→CH2ClCH=CHCH2Cl
;(5)下列化合物中能与E发生化学反应的是
d
d
.a.NaOH b.Na2CO3 c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):

