网址:http://m.1010jiajiao.com/timu3_id_381300[举报]
已知:可逆反应N:(g)+3H2(g)![]() 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是( )
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是( )
A.达平衡时甲中N:的转化率为75%
B.达平衡时甲、乙中NH,的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动
D.乙中反应的热化学方程式为2NH3(g)![]() N2(g)+3H2(g)△H=+Q2kJ/mol
N2(g)+3H2(g)△H=+Q2kJ/mol
(10分)(1)可逆反应N2(g)+3H2(g) 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
(2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s) 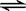 Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。
③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________ 。
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2 (g) 2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)
 2NH3(g) △H<0 。
2NH3(g) △H<0 。氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:

正反应速率最大的点是 (选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是 (选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 | c(CO2) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OCH3) /mol·L-1 | c(H2O) /mol·L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | |
(10分)(1)可逆反应N2(g)+3H2(g) 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
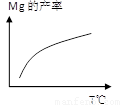
(2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s)  Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。
③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________ 。
查看习题详情和答案>>
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2
(g)  2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g)
+ 3H2(g)
 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
|
容器编号 |
起始时各物质物质的量/mol |
平衡时反应 |
||
|
N2 |
H2 |
NH3 |
||
|
a |
1 |
3 |
0 |
23.1 |
|
b |
2 |
6 |
0 |
未知(用E表示) |
下列说法正确的是 (填序号)
① 反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)  2NH3(g)
△H<0 。
2NH3(g)
△H<0 。
氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:

正反应速率最大的点是 (选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是 (选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
|
容器 |
c(CO2) /mol·L-1 |
c(H2) /mol·L-1 |
c(CH3OCH3) /mol·L-1 |
c(H2O) /mol·L-1 |
v (正)和v (逆)比较 |
|
容器I |
1.0×10-2 |
1.0×10-2 |
1.0×10-4 |
1.0×10-4 |
v (正)=v (逆) |
|
容器II |
2.0×10-2 |
1.0×10-2 |
1.0×10-4 |
2.0×10-4 |
|
容器I中的反应 (选填“是”或“否”)达到平衡状态,该反应在温度为T时的平衡常数K= 。表格内的空格处v(正)与v(逆)的大小关系是 。
查看习题详情和答案>>