摘要:能与镁条燃烧的气体有哪些?------CO2,SO2.O2.N2
网址:http://m.1010jiajiao.com/timu3_id_381017[举报]
资料显示:镁与饱和碳酸氢钠溶液反应时会生成大量气体和白色不溶物.某同学设计了如下实验方案来验证产物、探究反应原理.
(1)提出假设
实验1:用砂纸去掉镁条表面的氧化膜,将其放入盛有适量滴有酚酞试液的饱和碳酸氢钠溶液的试管中,迅速反应,生成大量气泡和白色不溶物,溶液由浅红色变成红色.
该同学对反应中生成的白色不溶物进行如下猜想:
猜想1:白色不溶物可能是
猜想2:白色不溶物可能是MgC03;
猜想3:白色不溶物可能是碱式碳酸镁[xMgCO3?yMg(OH)2].
(2)设计定性实验确定产物并验证猜想:
(3)为进一步确定实验Ⅰ的产物,设计了如下的定量实验方案,实验装置如图所示: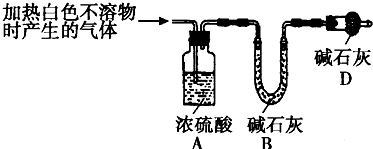
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并将分解产生的气体全部通入上述装置中.实验前后装置A的质量增加1.8g,装置B的质量增加8.8g,试确定白色不溶物的化学式:
查看习题详情和答案>>
(1)提出假设
实验1:用砂纸去掉镁条表面的氧化膜,将其放入盛有适量滴有酚酞试液的饱和碳酸氢钠溶液的试管中,迅速反应,生成大量气泡和白色不溶物,溶液由浅红色变成红色.
该同学对反应中生成的白色不溶物进行如下猜想:
猜想1:白色不溶物可能是
Mg(OH)2
Mg(OH)2
;猜想2:白色不溶物可能是MgC03;
猜想3:白色不溶物可能是碱式碳酸镁[xMgCO3?yMg(OH)2].
(2)设计定性实验确定产物并验证猜想:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成为 ①氢气 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤, 加入足量 ②稀盐酸 ②稀盐酸 |
③产生气体沉淀全部溶解 ③产生气体沉淀全部溶解 |
白色不溶物可能是MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清溶液, 向其中加入少量稀CaCl2溶液 |
产生白色沉淀 | 溶液中存在 ④CO32- ④CO32- |

称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并将分解产生的气体全部通入上述装置中.实验前后装置A的质量增加1.8g,装置B的质量增加8.8g,试确定白色不溶物的化学式:
Mg(OH)2(CO3)2或2MgCO3?Mg(OH)2
Mg(OH)2(CO3)2或2MgCO3?Mg(OH)2
.(2013?湖南模拟)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理.
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3?yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:
查看习题详情和答案>>
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为
Mg(OH)2
Mg(OH)2
.猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3?yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | ①气体成分为 氢气 氢气 |
| 实验Ⅲ | ②取实验Ⅰ中的白色不溶物,洗涤,加入足量 稀盐酸 稀盐酸 |
③ 产生气泡沉淀全部溶解 产生气泡沉淀全部溶解 |
白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | ④溶液中存在 CO32- CO32- |

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:
Mg(OH)2(CO3)2或2MgCO3?Mg(OH)2
Mg(OH)2(CO3)2或2MgCO3?Mg(OH)2
.(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:
NaHCO3溶液中存在平衡,HCO3-?H++CO32-、H2O?H++OH-;Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物Mg(OH)2?2MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行
NaHCO3溶液中存在平衡,HCO3-?H++CO32-、H2O?H++OH-;Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物Mg(OH)2?2MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行
.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理.
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为______.
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3?yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | ①气体成分为 ______ |
| 实验Ⅲ | ②取实验Ⅰ中的白色不溶物,洗涤,加入足量______ | ③______ | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | ④溶液中存在 ______ |
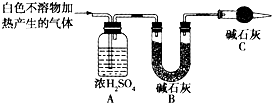
称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:______.
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:______. 查看习题详情和答案>>
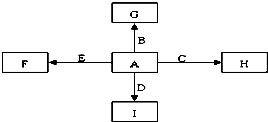 A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G
| 高温 |
②I是一种常见的温室气体,它和E可以发生反应:2E+I
| ||
(1)①中反应的化学方程式为
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
;
| ||
(2)化合物Ⅰ的电子式为
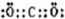
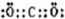
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量
0.64g
0.64g
;(4)C与过量NaOH溶液反应的化学方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
,反应后溶液与过量化合物Ⅰ反应的化学方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
;(5)E在I中燃烧可能观察到的现象是
镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳
镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳
.(2013?河池模拟)已知:①Br2与Cl2一样能氧化氨气.3Cl2+8NH3=N2+6NH4Cl
②镁条能在N2中燃烧生成黄绿色固体,遇水剧烈反应生成两种碱.
某化学学习小组设计下列装置来制取氨气并完成相关实验.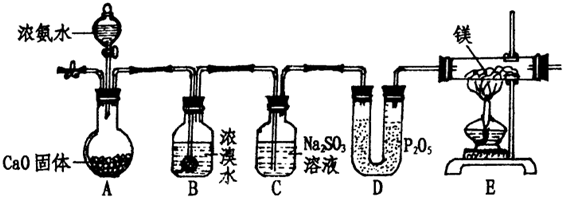
(1)实验步骤:
①点燃E处酒精灯;
②打开A中分液漏斗活塞;
③连接装置,检查装置气密性;
④通入惰性气体,排出装置内空气;
⑤装入各仪器药品.
其操作顺序是
(2)A处固体CaO的作用是
(3)写出B处反应方程式
(4)C处亚硫酸钠的作用是:
(5)能说明反应过程有N2生成的现象是
(6)此装置不足之处是
查看习题详情和答案>>
②镁条能在N2中燃烧生成黄绿色固体,遇水剧烈反应生成两种碱.
某化学学习小组设计下列装置来制取氨气并完成相关实验.

(1)实验步骤:
①点燃E处酒精灯;
②打开A中分液漏斗活塞;
③连接装置,检查装置气密性;
④通入惰性气体,排出装置内空气;
⑤装入各仪器药品.
其操作顺序是
③⑤④①②
③⑤④①②
.(填序号)(2)A处固体CaO的作用是
CaO吸水且放出大量热,有利于氨气逸出
CaO吸水且放出大量热,有利于氨气逸出
;(3)写出B处反应方程式
3Br2+8NH3=N2+6NH4Br
3Br2+8NH3=N2+6NH4Br
;(4)C处亚硫酸钠的作用是:
除去氮气中混有少量的Br2和NH3,Br2+SO32-+H2O=SO42-+2Br-+2H+,H++NH3=NH4+
除去氮气中混有少量的Br2和NH3,Br2+SO32-+H2O=SO42-+2Br-+2H+,H++NH3=NH4+
(用文字及相关离子方程式叙述);(5)能说明反应过程有N2生成的现象是
E中有黄绿色固体生成
E中有黄绿色固体生成
;(6)此装置不足之处是
不能阻止空气中水蒸气进入,使生成物不纯,且产生氨气污染空气
不能阻止空气中水蒸气进入,使生成物不纯,且产生氨气污染空气
.