摘要:10. 放电 放电 (1)①3O2======2O3 ②N2+O2======2NO (2)2H2SO3+O2=====2H2SO4 (3)负极:2Fe-4e-=2Fe2+ 正极:O2+4e-+2H2O=4OH- 原电池总反应:2Fe+O2+2H2O=2Fe(OH)2 生成铁锈反应: 4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3=Fe2O3·nH2O+(3-n)H2O
网址:http://m.1010jiajiao.com/timu3_id_380909[举报]
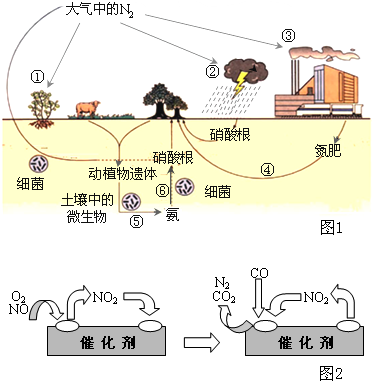 氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图1是自然界中氮的循环图,请回答有关问题.
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图1是自然界中氮的循环图,请回答有关问题.(1)从空气中获取氮是人类长久以来追求的目标.下列有关说法正确的是
a.图中①②③④⑤都属于自然界的固氮过程
b.在过程⑥中,氮元素的化合价降低
c.反应②的化学方程式是N2+O2
| ||
d.德国化学家哈伯发明了合成氨工艺,其主要反应如下
2NH4Cl+Ca(OH)2
| ||
(2)氨经氧化后可得到硝酸,而硝酸能与氨形成含氮量很高的肥料NH4NO3,施用于土壤而实现非自然形式的氮循环.但这种肥料不适宜与碱性物质共用,否则会降低肥效,其原因是
(3)人类活动对氮循环产生着明显的影响.汽车尾气中的NO,是造成光化学烟雾的物质之一,但NO对人体又起着独特的生理作用,被誉为“明星分子”,有三位科学家因此项研究成果而获得1998年诺贝尔奖.上述事实说明我们应辨证地看待化学物质的作用.
科技人员已经找到了一些解决NO排放的方法.在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分.气体在催化剂表面吸附与解吸作用的机理如图2所示.
写出上述变化中的总化学反应方程式
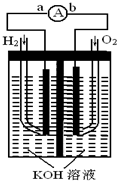 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:(1)氢氧燃料电池的能量转化主要形式是
化学能转变为电能
化学能转变为电能
,在导线中电子流动方向为由a到b
由a到b
(用a、b表示).(2)负极反应式为
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
.(3)电极表面镀铂粉的原因为
增大电极单位面积吸附H2、O2分子数?加快反应速率
增大电极单位面积吸附H2、O2分子数?加快反应速率
.(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
| ||
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是
Li
Li
,反应Ⅱ中的氧化剂是水
水
.②用锂吸收224L(标准状况)H2,生成的LiH与H2O作用后放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
32
32
mol.(5)肼一空气燃料电池是一种碱性电池,该电池放电时,肼作
负
负
极,其电极反应式为(生成无污染物质)N2H4-4e-+4OH-═N2+4H2O
N2H4-4e-+4OH-═N2+4H2O
.下列有关物质的性质和应用不相对应的是( )
| A、Na2O2能与CO2反应生成O2,可用于潜艇内供氧 | B、Cl2能与水反应生成HClO,可用于自来水的消毒 | C、Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 | D、N2与O2在放电时反应生成NO,此反应用于工业上制硝酸 |
(1)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用.回答下列问题:
①氮元素原子的L层电子数为 ;
②NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
③肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为 .
(2)一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2 (g)═XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是 .
②化合物XY2的摩尔质量是 .
③XY2分子中X、Y两元素质量比是3:16,X、Y两元素分别为 (写元素符号)
查看习题详情和答案>>
①氮元素原子的L层电子数为
②NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
③肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为
(2)一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2 (g)═XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是
②化合物XY2的摩尔质量是
③XY2分子中X、Y两元素质量比是3:16,X、Y两元素分别为