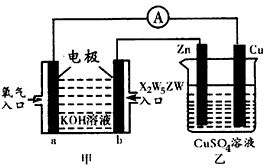
题目内容
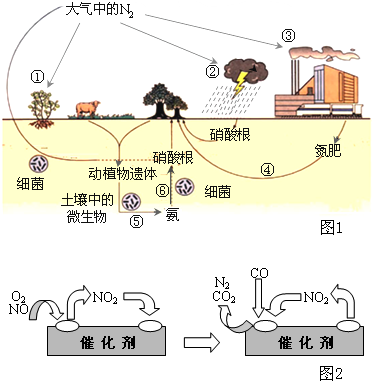 氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图1是自然界中氮的循环图,请回答有关问题.
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图1是自然界中氮的循环图,请回答有关问题.(1)从空气中获取氮是人类长久以来追求的目标.下列有关说法正确的是
a.图中①②③④⑤都属于自然界的固氮过程
b.在过程⑥中,氮元素的化合价降低
c.反应②的化学方程式是N2+O2
| ||
d.德国化学家哈伯发明了合成氨工艺,其主要反应如下
2NH4Cl+Ca(OH)2
| ||
(2)氨经氧化后可得到硝酸,而硝酸能与氨形成含氮量很高的肥料NH4NO3,施用于土壤而实现非自然形式的氮循环.但这种肥料不适宜与碱性物质共用,否则会降低肥效,其原因是
(3)人类活动对氮循环产生着明显的影响.汽车尾气中的NO,是造成光化学烟雾的物质之一,但NO对人体又起着独特的生理作用,被誉为“明星分子”,有三位科学家因此项研究成果而获得1998年诺贝尔奖.上述事实说明我们应辨证地看待化学物质的作用.
科技人员已经找到了一些解决NO排放的方法.在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分.气体在催化剂表面吸附与解吸作用的机理如图2所示.
写出上述变化中的总化学反应方程式
分析:(1)a.自然界中将游离态N转化为化合态的过程为自然固氮;
b.反应⑥中氨气转化为硝酸根离子;
c.反应②为放电下自然固氮;
d.德国化学家哈伯发明的合成氨工艺是将氮气和氢气在高温高压催化剂条件下转化成氨气;
(2)铵根离子与氢氧根离子会结合成氨气,降低肥效;
(3)催化转化器将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分,即生成氮气和二氧化碳.
b.反应⑥中氨气转化为硝酸根离子;
c.反应②为放电下自然固氮;
d.德国化学家哈伯发明的合成氨工艺是将氮气和氢气在高温高压催化剂条件下转化成氨气;
(2)铵根离子与氢氧根离子会结合成氨气,降低肥效;
(3)催化转化器将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分,即生成氮气和二氧化碳.
解答:解:(1)a.自然界中将游离态N转化为化合态的过程为自然固氮,则只有①②为自然固氮,故a错误;
b.反应⑥中氨气转化为硝酸根离子,N元素的化合价由-3价升高为+5价,故b错误;
c.反应②为放电下自然固氮,反应为N2+O2
2NO,故c正确;
d.德国化学家哈伯发明的合成氨工艺是将氮气和氢气在高温高压催化剂条件下转化成氨气,反应为N2+3H2 2NH3,故d错误;
2NH3,故d错误;
故答案为:c;
(2)铵根离子与氢氧根离子会结合成氨气,降低肥效,离子反应为NH4++OH-=NH3↑+H2O,故答案为:NH4++OH-=NH3↑+H2O;
(3)催化转化器将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分,即生成氮气和二氧化碳,该反应为2NO+2CO
N2+2CO2,
故答案为:2NO+2CO
N2+2CO2.
b.反应⑥中氨气转化为硝酸根离子,N元素的化合价由-3价升高为+5价,故b错误;
c.反应②为放电下自然固氮,反应为N2+O2
| ||
d.德国化学家哈伯发明的合成氨工艺是将氮气和氢气在高温高压催化剂条件下转化成氨气,反应为N2+3H2
 2NH3,故d错误;
2NH3,故d错误;故答案为:c;
(2)铵根离子与氢氧根离子会结合成氨气,降低肥效,离子反应为NH4++OH-=NH3↑+H2O,故答案为:NH4++OH-=NH3↑+H2O;
(3)催化转化器将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分,即生成氮气和二氧化碳,该反应为2NO+2CO
| ||
故答案为:2NO+2CO
| ||
点评:本题考查含氮物质及与环境的关系,为高频考点,把握习题中的信息、自然固氮及发生的化学反应为解答的关键,侧重化学反应的考查,题目难度不大

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)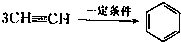 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
 2NO
2NO CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O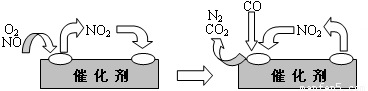
 CH
CH 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:__________________。
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:__________________。