摘要:11.(1)+(VO2)2SO4+ H2C2O4→2CO2↑+2VOSO4+2H2O (2)(VO2)2SO4 2mol (3)(VO2)2SO4+8NaOH→2Na3VO4+Na2SO4+4H2O
网址:http://m.1010jiajiao.com/timu3_id_37949[举报]
常温下,如果取0.1mol?L-1的HA溶液与0.1mol?L-1的NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因
(2)混合溶液中由水电离出的c(H+)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字)c(Na+)-c(A-)=
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH
查看习题详情和答案>>
(1)混合溶液的pH=8的原因
A-+H2O?HA+OH-
A-+H2O?HA+OH-
(用离子方程式表示).(2)混合溶液中由水电离出的c(H+)
>
>
0.1mol?L-1NaOH溶液中由水电离出的c(H+)(填“>”“<”或“=”).(3)求出混合溶液中下列算式的精确计算结果(填具体数字)c(Na+)-c(A-)=
9.9×10-7
9.9×10-7
mol?L-1.(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH
大于
大于
7(填“大于”“小于”或“等于”);将同温度下等浓度的四种盐溶液:A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl,按PH由大到小的顺序排列是A>B>D>C
A>B>D>C
(填字母).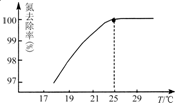 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.(1)已知:N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ?mol-1
2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1
①N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=
-622.2
-622.2
kJ?mol-1.②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是
△H>0,△S<0
△H>0,△S<0
.③用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是
NaClO+2NH3═N2H4+NaCl+H2O
NaClO+2NH3═N2H4+NaCl+H2O
.(2)采矿废液中的CN-可用H2O2处理.已知:H2SO4═H++HSO
- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
2HSO4--2e-═S2O82-+2H+
2HSO4--2e-═S2O82-+2H+
.(3)氧化镁处理含NH
+ 4 |
MgO+H2O?Mg(OH)2;
Mg(OH)2+2NH
+ 4 |
①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是
升高温度NH3的溶解度降低,有利于NH3的逸出
升高温度NH3的溶解度降低,有利于NH3的逸出
.②剩余的氧化镁,不会对废水形成二次污染,理由是
氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
.(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL;②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热;③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3═(NH4)2B4O7+5H2O];④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol?L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O═(NH4)2SO4+4H3BO3],记录消耗的体积V mL.则水样中氮的含量是
2 800cV
2 800cV
mg?L-1(用含c、V的表达式表示).物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡.请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、CO32-、H2O、
(2)常温时,Al2(SO4)3的水溶液呈
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl ②(NH4)2SO4 ③NH3?H2O ④(NH4)2CO3 ⑤NH4HSO4.溶液中c(NH4+)从大到小的顺序为:
(4)现有浓度均为0.1mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④碳酸钠,四种溶液中由水电离出的OH-浓度由大到小的顺序是(填序号
查看习题详情和答案>>
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、CO32-、H2O、
OH-、
OH-、
、H2CO3
H2CO3
.(填写微粒符号)(2)常温时,Al2(SO4)3的水溶液呈
酸
酸
(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
;实验室在配制Al2(SO4)3的溶液时,为了抑制Al2(SO4)3的水解可加入少量的硫酸
硫酸
(填写物质的名称).把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3
Al2O3
.(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl ②(NH4)2SO4 ③NH3?H2O ④(NH4)2CO3 ⑤NH4HSO4.溶液中c(NH4+)从大到小的顺序为:
②>④>⑤>①>③
②>④>⑤>①>③
.(填写溶液的序号)(4)现有浓度均为0.1mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④碳酸钠,四种溶液中由水电离出的OH-浓度由大到小的顺序是(填序号
④>②>③>①
④>②>③>①
. (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
Cl-+H2O
ClO-+H2↑
| ||
Cl-+H2O
ClO-+H2↑
电解后的溶液PH
| ||
大于
大于
7(填大于、小于、等于);其原因是ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(用离子方程式表示)(2)KAl(SO4)2溶液中质子守恒等式为
c(H+)=c(OH-)+3c(Al(OH)3)
c(H+)=c(OH-)+3c(Al(OH)3)
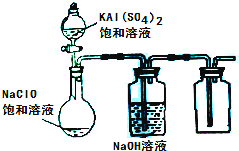
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验.
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀.此时反应的离子方程式为
3Cl-+Al3++3H2O=3HClO+Al(OH)3↓
3Cl-+Al3++3H2O=3HClO+Al(OH)3↓
.②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体.写出在光照射下混合液中反应的化学方程式是4HClO
2H2O+2Cl2↑+O2↑
| ||
4HClO
2H2O+2Cl2↑+O2↑
.
| ||
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4?FeSO4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生.此时烧瓶中发生的氧化还原反应的离子方程式为
3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-
3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-
.(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为
10.7
10.7
(忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)