网址:http://m.1010jiajiao.com/timu3_id_379466[举报]
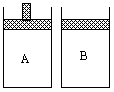
有两个容积相等的密闭容器A和B(如图所示),A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变.起始时这两个容器中分别充入等量按体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等.在400℃条件下,发生如下反应:2SO2(气)+O2(气)![]() 2SO3(气).填空:
2SO3(气).填空:
(1)达到平衡时,所需的时间t(A)________t(B),A容器中SO2的转化率比B容器中________.(填“大、小或相等”)
(2)达到(l)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡________移动,B容器中化学平衡________移动.(填“向左、向右或不”)
(3)达到(l)所述平衡后,若向两容器中通入等量原反应气体;再达到平衡时,A容器中C(SO3)________,B容器中SO3的质量分数________.(填“增大、减小或不变”)
查看习题详情和答案>>
| |||||||||||||||||||
有两个容积相等的密闭容器A和B(如右图)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等。在400℃条件下,发生如下反应:2SO2(g) + O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)达到平衡时,所需的时间t(A) t(B),A容器中SO2的转化率比B容器中 。(填“大、小或相等)
![]()
![]() (2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡 移动,B容器中化学平衡 移动。(填“向左、向右、不”)
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡 移动,B容器中化学平衡 移动。(填“向左、向右、不”)
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3) ,B容器中SO3的质量分数 。(填“增大、减少或不变”)
查看习题详情和答案>>(满分10分)有两个容积相等的密闭容器A和B(如图)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等。在400℃条件下,发生如下反应:2SO2(g) + O2(g)2SO3(g)。
(1)达到平衡时,所需的时间t(A) t(B),A容器中SO2的转化率比B容器中 。(填“大、小或相等)
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡 移动,B容器中化学平衡 移动。(填“向左、向右、不”)
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3) ,B容器中SO3的质量分数 。(填“增大、减少或不变”)
查看习题详情和答案>>
(满分10分)有两个容积相等的密闭容器A和B(如图)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等。在400℃条件下,发生如下反应:2SO2(g) + O2(g) 2SO3(g)。
2SO3(g)。
(1)达到平衡时,所需的时间t(A) t(B),A容器中SO2的转化率比B容器中 。(填“大、小或相等)
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡 移动,B容器中化学平衡 移动。(填“向左、向右、不”)
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3) ,B容器中SO3的质量分数 。(填“增大、减少或不变”)
