摘要:先后按图中所示电路测同一未知电阻的阻值Rx.已知两电路的路端电压恒定不变.若按图(1)所示电路测得电压表示数为6 V.电流表示数为2 mA.那么按图(2)所示电路测得的结果应有 A.电压表示数为6 V.电流表示数为2 mA B.电压表示数为6 V.电流表示数小于2 mA C.电压表示数小于6 V.电流表示数小于2 mA D.电压表示数小于6 V.电流表示数大于2 mA
网址:http://m.1010jiajiao.com/timu3_id_379317[举报]
 (2007?福田区模拟)某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右).但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种.现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
(2007?福田区模拟)某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右).但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种.现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:(1)实验开始时,仪器A中盛放电石,B中应装入
NaOH溶液
NaOH溶液
,其作用是除去混合气体中H2S等气体,避免催化剂中毒
除去混合气体中H2S等气体,避免催化剂中毒
.(2)仪器D中盛放水,其作用是
吸收生成的乙醛蒸气
吸收生成的乙醛蒸气
.(3)蒸馏烧瓶F中应加入HgO 和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各种试剂的名称
氧化汞→水→浓H2SO4
氧化汞→水→浓H2SO4
,将HgO加入F中的操作方法是将蒸馏烧瓶横放,用药匙或纸槽将HgO粉末送至烧瓶底,再慢慢竖立
将蒸馏烧瓶横放,用药匙或纸槽将HgO粉末送至烧瓶底,再慢慢竖立
.(4)装置图中,加热F的方式叫
水浴加热
水浴加热
.所选用温度计G的量程表示正确的是B
B
A.0℃~50℃B.0℃~100℃C.0℃~200℃D.50℃~100℃
(5)检验乙醛已制出的操作、现象是
取D中溶液少量,加入新制Cu(OH)2悬浊液,加热,若产生砖红色沉淀即可证明乙醛已制得
取D中溶液少量,加入新制Cu(OH)2悬浊液,加热,若产生砖红色沉淀即可证明乙醛已制得
.
如图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、试管夹均未画出).图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝或银丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液.
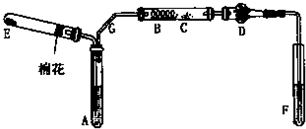
(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号) .
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是 .
(3)图中G导管倾斜的作用是 .
查看习题详情和答案>>

(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号)
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是
(3)图中G导管倾斜的作用是
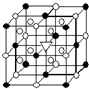 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子AlF6-
AlF6-
、Na+
Na+
;大立方体的体心处▽所代表的是AlF6-
AlF6-
.冰晶石在化工生产中的用途电解炼铝的助熔剂
电解炼铝的助熔剂
.(2)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
H2O2分子间存在氢键,与水分子可形成氢键
H2O2分子间存在氢键,与水分子可形成氢键
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体.写出铜原子价电子层的电子排布式
3d104s1
3d104s1
,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr
Cr
(填元素符号).实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有共价键和配位键
共价键和配位键
.实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是降低Cu(NH3)4SO4?H2O的溶解度
降低Cu(NH3)4SO4?H2O的溶解度
.B.用含少量铁的氧化铜制取氯化铜晶体(CuCl2?xH2O).有如下操作:
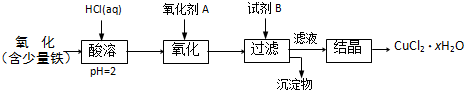
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解.
(1)加热酸溶过程中发生反应的离子方程式有:
Fe+2H+=Fe2++H2↑、CuO+2H+=Cu2++H2O
Fe+2H+=Fe2++H2↑、CuO+2H+=Cu2++H2O
(2)氧化剂A可选用
①
①
(填编号,下同)①Cl2 ②KMnO4 ③HNO3
(3)要得到较纯的产品,试剂B可选用
③
③
①NaOH ②FeO ③CuO
(4)试剂B的作用是
①③
①③
①提高溶液的pH ②降低溶液的pH ③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(5)从滤液经过结晶得到氯化铜晶体的方法是
②④①
②④①
(按实验先后顺序填编号)①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(6)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止、冷却、称量所得无水CuCl2的质量为n g.
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g.
试评价上述两种实验方案,其中正确的方案是
二
二
,据此计算得x=| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
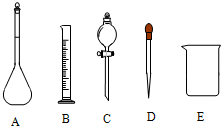 某环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.
某环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.(1)在图中所示仪器中,配制上述溶液不需要的是
C
C
(填如图相应仪器的序号).除图中已有仪器外,配制上述溶液还需要的玻璃仪器是玻璃棒
玻璃棒
,其作用按使用的先后顺序分别 是搅拌
搅拌
和引流
引流
.(2)根据计算,下列量程或规格中,本实验量筒应使用的是
A
A
,容量瓶应使用的是C
C
.(在横线上填写相应的序号)A.10mL B.100mL C.250mL D.500mL
(3)在量取浓盐酸后,下列操作的先后顺序是(用编号表示)
③①④②
③①④②
.①待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中.
②往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切.
③在盛浓盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
(4)在容量瓶的使用方法中,下列操作正确的是
AE
AE
.A.使用容量瓶前应检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转,摇匀
(5)假设配制时其他操作均正确,只出现以下某一情况,所配制的溶液浓度偏高的是
③④
③④
.①容量瓶中有少量蒸馏水,未干燥即将溶液转入
②烧杯和玻璃棒没有用蒸馏水洗涤2~3次
③量取浓盐酸后的量筒用蒸馏水洗涤2~3次,并将洗涤液倒入盛浓盐酸的烧杯
④定容时俯视容量刻度.
如图为某化学兴趣小组进行丁烷裂解的实验流程.(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略.)
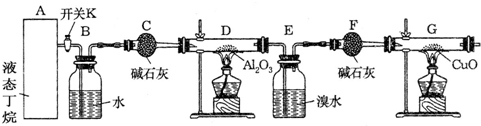
按图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气…
(1)这三步操作的先后顺序依次是 .
(2)简要说明排空气的方和证明空气已排尽的方法 .
(3)B装置所起的作用是 .
(4)若对E装置中的混和物再按以下流程实验:

①分离操作I、II的方法是:I ,II .
②Na2SO3溶液的作用是(用离子方程式表示) .
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应.当(E和F)装置的总质量比反应前增加了1.82g,G装置中固体质量减少了4.16g,则丁烷的裂解产物中:n(CH4):n(C2H6)= .
查看习题详情和答案>>

按图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气…
(1)这三步操作的先后顺序依次是
(2)简要说明排空气的方和证明空气已排尽的方法
(3)B装置所起的作用是
(4)若对E装置中的混和物再按以下流程实验:

①分离操作I、II的方法是:I
②Na2SO3溶液的作用是(用离子方程式表示)
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应.当(E和F)装置的总质量比反应前增加了1.82g,G装置中固体质量减少了4.16g,则丁烷的裂解产物中:n(CH4):n(C2H6)=