网址:http://m.1010jiajiao.com/timu3_id_379046[举报]
(本题共8分)
水煤气法制甲醇工艺流程框图如下

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
②下列能提高碳的平衡转化率的措施是 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4
(g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
|
物质 |
H2 |
CO |
CH3OH |
|
浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。
查看习题详情和答案>>
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO)不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9?c(CO2)?c(H2)=c(CO)?c(H2O),由此可以判断此时的温度为
 (2013?焦作一模)开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的.
(2013?焦作一模)开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的.(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是
乙是一种清洁燃料,工业上可用甲和氢气反应制得.
①T1温度时,在体积为2L的密闭容器中充入2mol甲和6mol H2,反应达到平衡后,测得c(甲)=0.2mol/L,则乙在平衡混合物中的物质的量分数是
| 1 |
| 3 |
| 1 |
| 3 |
②升高温度到T2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是
A.加入2mol甲 B.充入氮气 C.分离出乙 D.升高温度
(2)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的
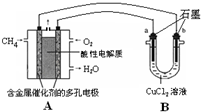
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是
②当线路中有0.1mol电子通过时,
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)若向容器中投入各物质2mol,加热到800℃使反应进行,则此时反应的生成物是
| 1 |
| 3 |
| 2 |
| 3 |
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
(2)在体积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速度v(CO2)=
Ⅱ.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650mg/L.现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2═KOCN+2KCl+H2O,则被氧化的元素是
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯