摘要:11.0.1MPa.500℃.将xL SO3通过装有V2O5的硬质玻璃管后.气体体积变为y L(气体体积均在同温同压下测定).该y L气体中SO3的体积分数是
网址:http://m.1010jiajiao.com/timu3_id_378952[举报]
 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H<0
(1)该反应450℃时的平衡常数
大于
大于
500℃时的平衡常数(填“大于”、“小于”或“等于”).(2)该化学达到平衡的标志是
b、d
b、d
.a.v(O2)正=2v( SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)恒温、密闭容器体系中充入一定量SO2、O2,反应达平衡时,某物理量随体系总压强(p)的关系如图所示所示.该物理量可能是
b、d
b、d
.a.平衡体系中SO2的体积分数
b.气体的平均相对分子质量
c.混合气体的密度
d.平衡体系中SO2的转化率
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=
0.036
0.036
mol?L-1?min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向
向正反应方向
移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36
0.36
mol<n(SO3)<0.40
0.40
mol.(5)压强及温度对SO2转化率的影响如表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
400℃~500℃
400℃~500℃
℃,压强0.1
0.1
MPa.(2011?丹东模拟)[化学-选修2化学与技术]硫酸工业在国民经济中占有极其重要的地位.请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫磺为原料,以硫磺为原料的优点是
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3由一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N282)利用表中数据分析,在实际生产中选择的适宜生产条件是:
温度
(3)选择适宜的催化剂,是否可以提高SO2的转化率?
(4)为提高SO3吸收率,实际生产中通常用
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是
A.保护环境,防止空气污染
B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率
D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
查看习题详情和答案>>
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫磺为原料,以硫磺为原料的优点是
生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化等
生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化等
.(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3由一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N282)利用表中数据分析,在实际生产中选择的适宜生产条件是:
温度
400℃~500℃
400℃~500℃
℃,压强0.1
0.1
MPa.| 压强/Mpa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
否
否
(填“是”或“否”),是否可以增大该反应所放出的热量?否
否
(填“是”或“否”).(4)为提高SO3吸收率,实际生产中通常用
98%的浓硫酸
98%的浓硫酸
吸收SO3.(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是
B
B
(填写序号)A.保护环境,防止空气污染
B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率
D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
石灰水
石灰水
(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式SO2+Ca(OH)2═CaSO3↓+H2O、CaSO3+H2SO4═CaSO4+SO2↑+H2O
SO2+Ca(OH)2═CaSO3↓+H2O、CaSO3+H2SO4═CaSO4+SO2↑+H2O
.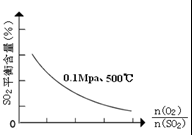 (1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
(1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)
| 催化剂 |
| △ |
0~4min时,容器气体压强为101KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①
②第5min时,从速率和转化率两个方面分析,改变的外界条件是
③在0.1Mpa、500℃时,起始时O2和SO2的物质的量之比
| n(O2) |
| n(SO2) |
| n(O2) |
| n(sO2) |
(2)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol?L-1的H2C2O4溶液滴加0.01mol?L-1KOH溶液V(mL),回答下列问题.
①当V<10mL时,反应的离子方程式为
②当V=10mL时,溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序为
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-);
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4);则a
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O42-)的值将
(2009?肇庆一模)硫酸的消费量常被作为国家工业发展水平的一种标志.工业合成硫酸最重要一步:2SO2(g)+O2 (g)?2SO3(g)△H<0.在一定条件下,将2mol SO2(g) 和1mol O2 (g) 充入2L密闭容器中,反应从起始到平衡后压强变为原来的11/15.回答下列问题:
(1)下表为2SO2(g)+O2 (g)?2SO3(g)反应的温度和压强对SO2转化率的影响:
你认为最好选择的压强是
(2)请计算题干条件下SO2的平衡转化率及SO3(g)?SO2(g)+1/2O2 (g)的平衡常数,写出计算过程(最后一步不必算出精确数值):
查看习题详情和答案>>
(1)下表为2SO2(g)+O2 (g)?2SO3(g)反应的温度和压强对SO2转化率的影响:
| 压强/MPa 温度/℃ |
0.1 | 0.5 | 1 | 10 | 常压为1.01x105 =101kPa =0.1MPa |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% | |
| 500 | 93.5% | 96.9% | 97.8% | 98.7% | |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
0.1MPa
0.1MPa
理由是:常压时SO2的转化率已经很高,若加压对设备要求高、增大投资和能耗
常压时SO2的转化率已经很高,若加压对设备要求高、增大投资和能耗
.(2)请计算题干条件下SO2的平衡转化率及SO3(g)?SO2(g)+1/2O2 (g)的平衡常数,写出计算过程(最后一步不必算出精确数值):
以下是反应2SO2+O2 2SO3在不同条件下进行时SO2的转化率:
2SO3在不同条件下进行时SO2的转化率:
从上表中你得到的启示?
(1)关于可逆反应的限度:
(2)提高该化学反应限度的途径有:
(3)要实现SO2的转化率为93.5%需控制的反应条件是
查看习题详情和答案>>
 2SO3在不同条件下进行时SO2的转化率:
2SO3在不同条件下进行时SO2的转化率:| 温度\压强 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(1)关于可逆反应的限度:
可逆反应中的反应物不能全部转化成生成物;(或可逆反应中的逆反应速率与正反应速率相等时,生成物和反应物的浓度不再改变,该反应就达到了一定的限度;或改变反应条件可以改变化学反应限度等)
可逆反应中的反应物不能全部转化成生成物;(或可逆反应中的逆反应速率与正反应速率相等时,生成物和反应物的浓度不再改变,该反应就达到了一定的限度;或改变反应条件可以改变化学反应限度等)
.(2)提高该化学反应限度的途径有:
增大压强或在一定范围内降低温度
增大压强或在一定范围内降低温度
.(3)要实现SO2的转化率为93.5%需控制的反应条件是
温度为500℃,压强为0.1MPa
温度为500℃,压强为0.1MPa
.