摘要:16.如图中长为L的轻杆A的一端固定一个质量为m的小球B. 另一端在水平轴O上.杆随轴O在树枝平面匀速转动.角速度为ω. 某时刻杆与水平方向成α角.如图所示.则此时杆对小球B的作用 力在图中哪个范围内? A.竖直向上 B.沿OB方向 C.图中区域Ⅰ D. 图中区域Ⅱ
网址:http://m.1010jiajiao.com/timu3_id_378851[举报]
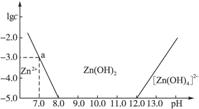
(10分)如图横坐标为溶液的pH值,纵坐标为Zn2+ 离子或Zn(OH)42-离子(配离子)物质的量浓度的对数,回答下列问题.

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为 。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)= 。
(3)某废液中含Zn2+ 离子,为提取Zn2+ 离子可以控制溶液中pH值的范围是 。
(4)往1L 1.00 mol?L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol (精确到小数点后2位)。
(5)25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/ (mol?L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103 c(PbCl2)/ (mol?L-1) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是 。
![]() A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
![]() B.PbCl2固体在0.50 mol?L-1盐酸中的溶解度小于在纯水中的溶解度
B.PbCl2固体在0.50 mol?L-1盐酸中的溶解度小于在纯水中的溶解度
![]() C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(配离子)
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(配离子)
![]() D.PbCl2固体可溶于饱和食盐水
D.PbCl2固体可溶于饱和食盐水
查看习题详情和答案>>
 如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的
如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的| 3 |
| 5 |
| A、气态氢化物的稳定性:A>D |
| B、B元素的两种同素异形体常温下都是气体 |
| C、最高价氧化物对应水化物的酸性:D>C |
| D、阴离子半径从大到小的排列顺序为:C>D>B |
如图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物.
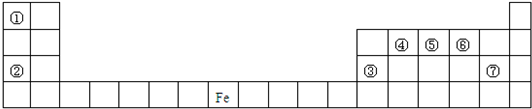
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
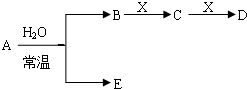
(1)若E为氧化物,则A与水反应的化学方程式为
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是
查看习题详情和答案>>

已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为氧化物,则A与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
,①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
Fe+4H++NO3-═Fe3++NO↑+2H2O
Fe+4H++NO3-═Fe3++NO↑+2H2O
(2)若E为单质气体,D为白色沉淀,A的化学式可能是
Na、Na2O2或NaH
Na、Na2O2或NaH
.
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.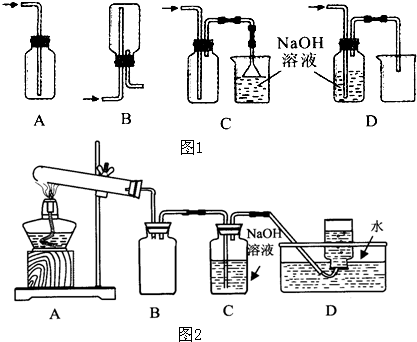
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验,如图1所示.
①写出该反应的离子方程式 ;
②下列收集Cl2的装置正确装置是 ;
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 ;
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, .
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验.
用如图2所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是 .
②经小组讨论并验证该无色气体为O2,其验证方法是 .
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:ⅠAg;ⅡAg2O;ⅢAg和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
【实验评价】根据上述实验,③不能确定固体产物成分的实验是 (填实验编号).
【实验结论】根据上述实验结果,④该小组得出的AgNO3固体热分解的化学方程式为 .
查看习题详情和答案>>

(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验,如图1所示.
①写出该反应的离子方程式
②下列收集Cl2的装置正确装置是
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验.
用如图2所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是
②经小组讨论并验证该无色气体为O2,其验证方法是
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:ⅠAg;ⅡAg2O;ⅢAg和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,④该小组得出的AgNO3固体热分解的化学方程式为