摘要:14.某学习兴趣小组取当地黏土土样进行如下实验. (1)分析土样中铝铁含量: ①在上述过程中反复用到的一个分离操作是 .该操作用到的仪器有 . ②样品中铁元素含量的数学表达式为 .此结果可能比实际的铁含量 .理由是 . ③写出上述溶液的离子方程式 . (2)秦砖汉瓦色泽经千年而不变.是我国劳动人民智慧的结晶.该兴趣小组利用土样烧制青色和红色的砖瓦. 乙装置在烧制快结束时要通入水蒸气.并且密闭冷却. ①在上述装置中.成品为红色的是 . ②现在工业上大都是烧制红色砖瓦.较少烧制青色砖瓦.你认为可能的原因是什么? .
网址:http://m.1010jiajiao.com/timu3_id_378557[举报]
某溶液中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
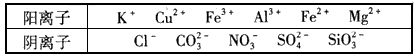
某学习兴趣小组欲探究该溶液的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察);
Ⅱ.取少量溶液,加入KSCN溶液无明显变化;
Ⅲ.另取少量溶液,加入少量盐酸,有气体生成;
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)判断原溶液中是否含有CO32-,答___;判断理由是___。
(2)原溶液中可能含有的离子是__,肯定不含有的离子是___(写离子符号)。
(3)Ⅳ中反应的离子方程式是___。
(4)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6 g,则原溶液中一定含有的离子是___(写离子符号)。
查看习题详情和答案>>
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察);
Ⅱ.取少量溶液,加入KSCN溶液无明显变化;
Ⅲ.另取少量溶液,加入少量盐酸,有气体生成;
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)判断原溶液中是否含有CO32-,答___;判断理由是___。
(2)原溶液中可能含有的离子是__,肯定不含有的离子是___(写离子符号)。
(3)Ⅳ中反应的离子方程式是___。
(4)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6 g,则原溶液中一定含有的离子是___(写离子符号)。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质.
Ⅰ.测定过氧化氢的含量
(1)取10.00mL密度为ρg/mL的过氧化氢溶液稀释至250mL,移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.用高锰酸钾标准溶液滴定被测试样,写出滴定过程中发生反应的离子方程式: .
(2)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 .
Ⅱ.探究过氧化氢的性质
(1)H2O2与铜的有关探究实验:
①将铜丝置于用硫酸酸化的H2O2溶液中,铜被迅速氧化,溶液变蓝;同时产生大量气体,经检测该气体能使余烬木条复燃,反应的离子方程式为: .
②将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是 ,写出产生气体这一现象的反应的化学方程式 .
(2)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现,这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,ClO-与H2O2反应的离子方程式是 .
查看习题详情和答案>>
Ⅰ.测定过氧化氢的含量
(1)取10.00mL密度为ρg/mL的过氧化氢溶液稀释至250mL,移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.用高锰酸钾标准溶液滴定被测试样,写出滴定过程中发生反应的离子方程式:
(2)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
Ⅱ.探究过氧化氢的性质
(1)H2O2与铜的有关探究实验:
①将铜丝置于用硫酸酸化的H2O2溶液中,铜被迅速氧化,溶液变蓝;同时产生大量气体,经检测该气体能使余烬木条复燃,反应的离子方程式为:
②将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是
(2)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现,这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,ClO-与H2O2反应的离子方程式是
(2010?潮州二模)过氧化氢是重要的氧化剂、还原剂,其水溶液又称双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定过氧化氢的含量,并探究过氧化氢的性质、用途.
Ⅰ.测定过氧化氢的含量
(1)移取10.00mL密度为ρ g/mL的过氧化氢溶液至250mL 容量瓶中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
.
(3)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
Ⅱ.探究过氧化氢的性质
(4)该化学兴趣小组根据所提供的实验条件设计了两个实验,分别验证过氧化氢的氧化性和不稳定性.(实验试剂只有:过氧化氢溶液、稀硫酸、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选.)请填写他们的实验方法和实验现象的表中空白:
Ⅲ.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜
(5)印刷电路板金属粉末中的Cu在H2SO4与H2O2溶液中反应生成Cu2+和H2O的离子方程式为
(6)控制其他条件相同,印刷电路板的Cu用10%H2O2和3.0mol/L H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率如下表:
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
查看习题详情和答案>>
Ⅰ.测定过氧化氢的含量
(1)移取10.00mL密度为ρ g/mL的过氧化氢溶液至250mL 容量瓶中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
| 17Cv |
| 200ρ |
| 17Cv |
| 200ρ |
(3)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
偏高
偏高
(填“偏高”或“偏低”或“不变”).Ⅱ.探究过氧化氢的性质
(4)该化学兴趣小组根据所提供的实验条件设计了两个实验,分别验证过氧化氢的氧化性和不稳定性.(实验试剂只有:过氧化氢溶液、稀硫酸、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选.)请填写他们的实验方法和实验现象的表中空白:
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | 取适量碘化钾淀粉溶液、稀硫酸于试管中,滴入过氧化氢溶液.(或:取适量饱和硫化氢溶液于试管中,滴入过氧化氢溶液.) | 溶液变蓝色 溶液变蓝色 .(或: 产生淡黄色沉淀或溶液变浑浊 产生淡黄色沉淀或溶液变浑浊 ) |
| 验证热不稳定性 | 取适量过氧化氢溶液于试管中, 稍微加热 稍微加热 用带火星的木条检验 用带火星的木条检验 . |
产生气泡,带火星的木条复燃. |
(5)印刷电路板金属粉末中的Cu在H2SO4与H2O2溶液中反应生成Cu2+和H2O的离子方程式为
Cu+H2O2+2H+=Cu2++2H2O
Cu+H2O2+2H+=Cu2++2H2O
.(6)控制其他条件相同,印刷电路板的Cu用10%H2O2和3.0mol/L H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
温度升高,H2O2分解速率加快
温度升高,H2O2分解速率加快
.(2011?奉贤区一模)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质.
Ⅰ.测定过氧化的含量
请填写下列空白:
(1)移取10.00mL密度为ρ g/mL的过氧化氢溶液至250mL
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关化学式前的系数及化学式填写在横线上.
(3)滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是
(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
.
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
Ⅱ.探究过氧化氢的性质
该化学举小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性.(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选.)
请将他们的实验方法和实验现象填入下表:(只要完成其中一项探究即可)
查看习题详情和答案>>
Ⅰ.测定过氧化的含量
请填写下列空白:
(1)移取10.00mL密度为ρ g/mL的过氧化氢溶液至250mL
容量瓶
容量瓶
(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关化学式前的系数及化学式填写在横线上.
2
2
MnO4-+5
5
H2O2+6
6
H+→2
2
Mn2++8
8
H2O+502
502
(3)滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是
滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且30秒内不褪色
滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且30秒内不褪色
.(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
| 0.085cV |
| ρ |
| 0.085cV |
| ρ |
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
偏高
偏高
(填“偏高”“偏低”“不变”).Ⅱ.探究过氧化氢的性质
该化学举小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性.(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选.)
请将他们的实验方法和实验现象填入下表:(只要完成其中一项探究即可)
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 探究氧化性 | 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液.(取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液.) 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液.(取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液.) |
产生淡黄色沉淀或溶液变浑浊.(溶液变蓝色.) 产生淡黄色沉淀或溶液变浑浊.(溶液变蓝色.) |
| 或探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验.(取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中.) 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验.(取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中.) |
产生气泡,木条复燃.(溶液变浑浊或有浅黄色沉淀产生) 产生气泡,木条复燃.(溶液变浑浊或有浅黄色沉淀产生) |
(1)含铬元素的废水必须治理达标.某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3.该方案运用了污水处理方法中的氧化还原法和
(2)明矾是一种常见的混凝剂,明矾净水的原理为(写出离子方程式):
(3)我国酸雨属SO2污染型.某校兴趣小组取雨水样品进行实验.每隔一段时间测定雨水的pH,得到的结果如下表
该雨水样品的pH变化的原因用化学方程式表示
(4)现代生活离不开金属材料,下列钢铁的防腐方法中,防腐效果最好,但相对费用也最贵的是
查看习题详情和答案>>
沉淀法
沉淀法
.指导老师指出该方案处理后的废水中因含有大量NH4+
NH4+
(填离子符号),能导致水体富营养化.(2)明矾是一种常见的混凝剂,明矾净水的原理为(写出离子方程式):
Al3++3H2O Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
 Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+Al3++3H2O Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
. Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+(3)我国酸雨属SO2污染型.某校兴趣小组取雨水样品进行实验.每隔一段时间测定雨水的pH,得到的结果如下表
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
2H2SO3+O2=2H2SO4或2SO2+2H2O+O2=2H2SO4
2H2SO3+O2=2H2SO4或2SO2+2H2O+O2=2H2SO4
.(4)现代生活离不开金属材料,下列钢铁的防腐方法中,防腐效果最好,但相对费用也最贵的是
c
c
(填字母). a.涂油漆 b.包塑料层(镀塑) c.制成不锈钢.