网址:http://m.1010jiajiao.com/timu3_id_378293[举报]

(1)A是④的最高价含氧酸,其化学式为______,A中所含的化学键类型为______.
(2)将③对应的单质投入A的稀溶液中,发生的反应属于______ 反应(填“吸热”或“放热”),该反应中反应物的总能量______生成物的总能量(填“大于”或“小于”);若将③对应的单质和铁用导线连接后投入A的稀溶液中,组成的装置中能量转化形式主要是______,该装置正极材料是______.
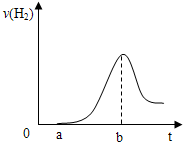
(3)把在空气中久置的③的单质投入A的稀溶液中,产生氢气的速率与反应时间的关系可用如图曲线表示:
曲线0→a段不产生氢气的原因是______,曲线a→b段产生氢气速率逐渐增大的主要原因是______,
曲线由b以后产生氢气速率逐渐减小的主要原因是______.
(4)①和②对应的单质在一个固定体积的密闭容器中发生可逆反应,该反应达到平衡的标志是______(请列举一项).

(1)A是④的最高价含氧酸,其化学式为______,A中所含的化学键类型为______.
(2)将③对应的单质投入A的稀溶液中,发生的反应属于______ 反应(填“吸热”或“放热”),该反应中反应物的总能量______生成物的总能量(填“大于”或“小于”);若将③对应的单质和铁用导线连接后投入A的稀溶液中,组成的装置中能量转化形式主要是______,该装置正极材料是______.
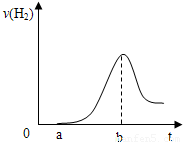
(3)把在空气中久置的③的单质投入A的稀溶液中,产生氢气的速率与反应时间的关系可用如图曲线表示:
曲线0→a段不产生氢气的原因是______,曲线a→b段产生氢气速率逐渐增大的主要原因是______,
曲线由b以后产生氢气速率逐渐减小的主要原因是______.
(4)①和②对应的单质在一个固定体积的密闭容器中发生可逆反应,该反应达到平衡的标志是______(请列举一项).
 查看习题详情和答案>>
查看习题详情和答案>>

(1)A是④的最高价含氧酸,其化学式为
(2)将③对应的单质投入A的稀溶液中,发生的反应属于
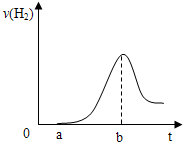
(3)把在空气中久置的③的单质投入A的稀溶液中,产生氢气的速率与反应时间的关系可用如图曲线表示:
曲线0→a段不产生氢气的原因是
曲线由b以后产生氢气速率逐渐减小的主要原因是
(4)①和②对应的单质在一个固定体积的密闭容器中发生可逆反应,该反应达到平衡的标志是
| |||||||||||||||||||||||||||||
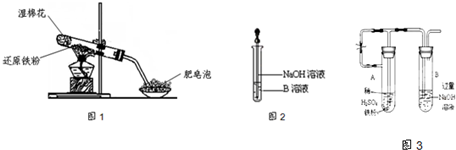
已知:①FeO+2H+=Fe2++H2O②Fe2O3+6H+=2Fe3++3H2O ③Fe3O4+8H+=Fe2++2Fe3++4H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为
| ||
| ||
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有FeE.只有Fe3O4
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用图3所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应.获得不含O2的蒸馏水的方法是
一段时间后,关闭止水夹,在试管