题目内容
下表是周期表中的一部分,请回答下列问题:

(1)A是④的最高价含氧酸,其化学式为______,A中所含的化学键类型为______.
(2)将③对应的单质投入A的稀溶液中,发生的反应属于______ 反应(填“吸热”或“放热”),该反应中反应物的总能量______生成物的总能量(填“大于”或“小于”);若将③对应的单质和铁用导线连接后投入A的稀溶液中,组成的装置中能量转化形式主要是______,该装置正极材料是______.
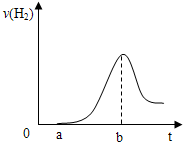
(3)把在空气中久置的③的单质投入A的稀溶液中,产生氢气的速率与反应时间的关系可用如图曲线表示:
曲线0→a段不产生氢气的原因是______,曲线a→b段产生氢气速率逐渐增大的主要原因是______,
曲线由b以后产生氢气速率逐渐减小的主要原因是______.
(4)①和②对应的单质在一个固定体积的密闭容器中发生可逆反应,该反应达到平衡的标志是______(请列举一项).

(1)A是④的最高价含氧酸,其化学式为______,A中所含的化学键类型为______.
(2)将③对应的单质投入A的稀溶液中,发生的反应属于______ 反应(填“吸热”或“放热”),该反应中反应物的总能量______生成物的总能量(填“大于”或“小于”);若将③对应的单质和铁用导线连接后投入A的稀溶液中,组成的装置中能量转化形式主要是______,该装置正极材料是______.

(3)把在空气中久置的③的单质投入A的稀溶液中,产生氢气的速率与反应时间的关系可用如图曲线表示:
曲线0→a段不产生氢气的原因是______,曲线a→b段产生氢气速率逐渐增大的主要原因是______,
曲线由b以后产生氢气速率逐渐减小的主要原因是______.
(4)①和②对应的单质在一个固定体积的密闭容器中发生可逆反应,该反应达到平衡的标志是______(请列举一项).
由元素在周期表中的位置可知,①为H,②为N,③为Al,④为S,
(1)硫元素最高价含氧酸是H2SO4,属于共价化合物,含有共价键,
故答案为:H2SO4;共价键;
(2)Al与稀硫酸的反应是放热反应,故反应物的总能量大于生成物的总能量;
若Al和铁用导线连接后投入硫酸的稀溶液中,组成原电池,化学能转化为电能,Al较活泼作负极、Fe较不活泼作正极,
故答案为:放热;大于;化学能转化为电能;Fe;
(3)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成致密的氧化铝膜,限制了铝与H2SO4的反应,氧化铝首先稀硫酸反应生成氯化铝和水,不产生H2;
金属和酸的反应是放热反应,使溶液的温度升高,曲线a→b段温度升高是影响反应速率的主要因素,化学反应速率加快;
随着反应的进行,溶液中的氢离子浓度逐渐降低,曲线由b以后氢离子浓度是影响化学反应速率的主要因素,所以反应速率逐渐减小;
故答案为:铝表面被O2氧化为致密的氧化膜,限制了铝与H2SO4的反应;反应放热,温度升高是影响反应速率的主要因素,使反应速率增大;随反应c(H+)减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降;
(4)可逆反应到达平衡时,正逆反应速率相等,各成分的浓度(或质量、物质的量、压强等)不再变化,
故答案为:各成分的浓度(或质量、物质的量、压强等)不再变化.
(1)硫元素最高价含氧酸是H2SO4,属于共价化合物,含有共价键,
故答案为:H2SO4;共价键;
(2)Al与稀硫酸的反应是放热反应,故反应物的总能量大于生成物的总能量;
若Al和铁用导线连接后投入硫酸的稀溶液中,组成原电池,化学能转化为电能,Al较活泼作负极、Fe较不活泼作正极,
故答案为:放热;大于;化学能转化为电能;Fe;
(3)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成致密的氧化铝膜,限制了铝与H2SO4的反应,氧化铝首先稀硫酸反应生成氯化铝和水,不产生H2;
金属和酸的反应是放热反应,使溶液的温度升高,曲线a→b段温度升高是影响反应速率的主要因素,化学反应速率加快;
随着反应的进行,溶液中的氢离子浓度逐渐降低,曲线由b以后氢离子浓度是影响化学反应速率的主要因素,所以反应速率逐渐减小;
故答案为:铝表面被O2氧化为致密的氧化膜,限制了铝与H2SO4的反应;反应放热,温度升高是影响反应速率的主要因素,使反应速率增大;随反应c(H+)减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降;
(4)可逆反应到达平衡时,正逆反应速率相等,各成分的浓度(或质量、物质的量、压强等)不再变化,
故答案为:各成分的浓度(或质量、物质的量、压强等)不再变化.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下表为元素周期表的一部,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)请写出②的元素符号
(2)请写出③的最高价氧化物的电子式 .
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示) .
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 (填编号).
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
| 族周期 | IA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)请写出③的最高价氧化物的电子式 .
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示) .
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 (填编号).
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
