摘要:16.A.B.C.D..F六种物质在一定条件下有下图所示的相互转化关系.所有反应物和生成物均已给出. (1)若反应①.②.③均为水溶液中的置换反应.A.D.E为卤素单质.则A是 (2)若反应①.②.③均为水溶液中的置换反应.A.D.E为Zn.Fe.Cu中的某种金属.则A是 .B.C.F三种物质中的阴离子应 . (3)若B是水.C是生产生活中应用最广泛的金属所对应的一种具有磁性的黑色氧化物.D是相同条件下密度最小的气体.E是一种无色.无味的有毒气体.则反应③的化学方程式是 . (4)若B为一种淡黄色固体.绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环.则反应①的离子方程式是 .在反应③中.若1molD.则转移电子的物质的量为 .
网址:http://m.1010jiajiao.com/timu3_id_378253[举报]
有A、B、C、D.E、F六种含六个以内碳原子的含氧衍生物,它们的质量组成均含C 40%,含H 6.67%;燃烧等物质的量的A、B、C、D生成的CO2体积比为6∶2∶1∶3,燃烧等物质的量的E、F生成水的物质的量比为1∶3,A、B、C、F均可发生银镜反应,D、E显酸性,D在铜作催化剂时在空气中加热可反应,但产物不发生银镜反应,推断出A、B、C、D、E、F各是什么物质?
查看习题详情和答案>>
有A、B、C、D.E、F六种含六个以内碳原子的含氧衍生物,它们的质量组成均含C 40%,含H 6.67%;燃烧等物质的量的A、B、C、D生成的CO2体积比为6∶2∶1∶3,燃烧等物质的量的E、F生成水的物质的量比为1∶3,A、B、C、F均可发生银镜反应,D、E显酸性,D在铜作催化剂时在空气中加热可反应,但产物不发生银镜反应,推断出A、B、C、D、E、F各是什么物质?
查看习题详情和答案>>A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族.A、C能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.B元素基态原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素.根据以上信息回答下列问题:
(1)D元素的名称为
(2)C、D、F的简单离子中,半径最小的是
(3)BA4的空间构型为
(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
(5)下列关于甲和乙的说法中,错误的是
①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
查看习题详情和答案>>
(1)D元素的名称为
氟
氟
,E的电子排布式为ls22s22p63s1
ls22s22p63s1
;(2)C、D、F的简单离子中,半径最小的是
Al3+
Al3+
(填离子符号);(3)BA4的空间构型为
正四面体
正四面体
,B、C两元素形成的非极性分子的结构式为O=C=O
O=C=O
;(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
,可以相互反应生成O2的化学方程式为2Na2O2+CO2═2Na2CO3+O2
2Na2O2+CO2═2Na2CO3+O2
;(5)下列关于甲和乙的说法中,错误的是
①③⑤
①③⑤
(填序号)①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
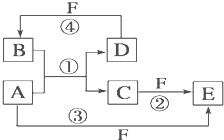 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质(一种黑色固体),且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,则A在周期表中的位置为:
第三周期,ⅡA族
第三周期,ⅡA族
,B的电子式为::O::C::O:
:O::C::O:
,F的浓溶液与D在加热条件下反应的化学方程式为:C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3
CO2↑+4NO2↑+2H2O
.
| ||
(2)若A是常见变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行.则反应②的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(3)若A、D、F都是短周期非金属元素单质,且 A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,则B是
SiO2
SiO2
,C是CO
CO
,F是O2
O2
.(填化学式)A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式
 ;乙为由B元素组成的单质,写出该单质的一种用途
;乙为由B元素组成的单质,写出该单质的一种用途
(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:
 .
.
(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
查看习题详情和答案>>
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式


作保护气
作保护气
.(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
Fe3O4+8H+═2Fe3++Fe2++4H2O
Fe3O4+8H+═2Fe3++Fe2++4H2O
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
NH4NO2+AgNO3═AgNO2↓+NH4NO3
NH4NO2+AgNO3═AgNO2↓+NH4NO3
,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为C(NO2->C(NH4+)>C(H+)>C(OH-)
C(NO2->C(NH4+)>C(H+)>C(OH-)
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:


(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
.为探究该复盐中的某种离子,取少量该复盐于试管中并加水溶解,滴加铁氰化钾溶液(K3[Fe(CN)6]),则现象和结论为出现蓝色沉淀,证明有Fe2+
出现蓝色沉淀,证明有Fe2+
.