摘要: , (2) (3)生成红色沉淀和无色气体.溶液变蓝色 (4)CuH + 3H+ + NO3- = Cu2+ + NO↑ + 2 H2O
网址:http://m.1010jiajiao.com/timu3_id_378191[举报]
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
×100%
×100%.
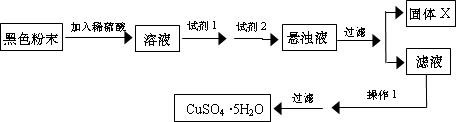
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
试回答:
①试剂I为
②固体X的化学式为
③操作I为
查看习题详情和答案>>
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
溶液变为血红色
溶液变为血红色
.(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
不合理
不合理
简述你的理由(不需写出反应的方程式 )Cu能将Fe3+还原为Fe2+
Cu能将Fe3+还原为Fe2+
.(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
Fe2O3和Cu2O的混合物
Fe2O3和Cu2O的混合物
,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+
Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+
.探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:

试回答:
①试剂I为
B
B
,试剂II为D
D
(填字母).②固体X的化学式为
Fe(OH)3
Fe(OH)3
.③操作I为
加热蒸发
加热蒸发
.(2009?清远模拟)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料
Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
×100%
×100%.
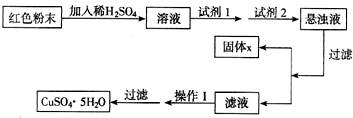
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4.5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
试回答:
试剂1为
查看习题详情和答案>>
查阅资料
Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
没有红色不溶物,滴加KSCN溶液,溶液变为红色
没有红色不溶物,滴加KSCN溶液,溶液变为红色
.(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
不合理
不合理
.简述你的理由(可不写反应的方程式 )Cu能将Fe3+还原为Fe2+
Cu能将Fe3+还原为Fe2+
.(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
Fe2O3和Cu2O的混合物
Fe2O3和Cu2O的混合物
,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
.探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4.5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:

试回答:
试剂1为
B
B
,试剂2为D
D
(填字母序号);固体x的化学式是Fe(OH)3
Fe(OH)3
.I、物质A-G有下图所示转化关系(部分反应物、生成物没有列出)其中A为某金属矿的主要成分,经过一系列反应可得到B和C.单质C可与E的浓溶液发生反应,G为砖红色沉淀.

请回答下列问题
(1)写出下列物质的化学式:B
(2)工业上B制备D在
(3)反应②的化学方程式是
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K=
II、“蓝瓶子”实验中使用的亚甲基蓝(C16H18ClN3S?3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne- 还原型(无色)
还原型(无色)
将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色…
(1)上述溶液由蓝色变无色的过程中,亚甲基蓝被
(2)上述溶液由无色变蓝色的过程中,亚甲基蓝被
查看习题详情和答案>>

请回答下列问题
(1)写出下列物质的化学式:B
SO2
SO2
EH2SO4
H2SO4
GCu2O
Cu2O
(2)工业上B制备D在
接触室
接触室
设备中进行.(3)反应②的化学方程式是
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
.
| ||
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K=
K=23.8
K=23.8
L?mol-1,若温度不变,再加入0.50mol氧气后重新达到平衡,平衡向右
向右
(填“向左”、“不变”、“向右”)移动,氧气的转化率降低
降低
,(填“升高”“不变”或“降低”),D的体积分数减小
减小
(填“增大”“不变”或“减小”)II、“蓝瓶子”实验中使用的亚甲基蓝(C16H18ClN3S?3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne-
 还原型(无色)
还原型(无色)将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色…
(1)上述溶液由蓝色变无色的过程中,亚甲基蓝被
还原
还原
(填“氧化”或“还原”,下同),其中还原
还原
剂是葡萄糖
葡萄糖
(填物质名称).(2)上述溶液由无色变蓝色的过程中,亚甲基蓝被
氧化
氧化
(填“氧化”或“还原”,下同),其中氧化剂是氧气
氧气
(填物质名称).
I、物质A-G有下图所示转化关系(部分反应物、生成物没有列出)其中A为某金属矿的主要成分,经过一系列反应可得到B和C.单质C可与E的浓溶液发生反应,G为砖红色沉淀.

请回答下列问题
(1)写出下列物质的化学式:B E G
(2)工业上B制备D在 设备中进行.
(3)反应②的化学方程式是 .
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K= L?mol-1,若温度不变,再加入0.50mol氧气后重新达到平衡,平衡 (填“向左”、“不变”、“向右”)移动,氧气的转化率 ,(填“升高”“不变”或“降低”),D的体积分数 (填“增大”“不变”或“减小”)
II、“蓝瓶子”实验中使用的亚甲基蓝是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne- 还原型(无色)
还原型(无色)
将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色…
(1)上述溶液由蓝色变无色的过程中,亚甲基蓝被 (填“氧化”或“还原”,下同),其中 剂是 (填物质名称).
(2)上述溶液由无色变蓝色的过程中,亚甲基蓝被 (填“氧化”或“还原”,下同),其中氧化剂是 (填物质名称). 查看习题详情和答案>>

请回答下列问题
(1)写出下列物质的化学式:B E G
(2)工业上B制备D在 设备中进行.
(3)反应②的化学方程式是 .
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K= L?mol-1,若温度不变,再加入0.50mol氧气后重新达到平衡,平衡 (填“向左”、“不变”、“向右”)移动,氧气的转化率 ,(填“升高”“不变”或“降低”),D的体积分数 (填“增大”“不变”或“减小”)
II、“蓝瓶子”实验中使用的亚甲基蓝是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne-
 还原型(无色)
还原型(无色)将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色…
(1)上述溶液由蓝色变无色的过程中,亚甲基蓝被 (填“氧化”或“还原”,下同),其中 剂是 (填物质名称).
(2)上述溶液由无色变蓝色的过程中,亚甲基蓝被 (填“氧化”或“还原”,下同),其中氧化剂是 (填物质名称). 查看习题详情和答案>>
(2011?四川二模)许多含氯物质与生活密切相关,如HClO、ClO2、NaClO2等都是重要的杀菌消毒剂和漂白剂.下列是重要的含氯漂白剂NaClO2的工业合成流程图.

已知:纯ClO2易炸,当空气中ClO2的浓度大于10%容易爆炸.回答下列问题:
(1)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)能否将ClO2气体用SO2气体稀释
(4)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为
(5)为了测定NaClO2?3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/L Na2S2O3标准液滴定,锥形瓶中溶液
查看习题详情和答案>>

已知:纯ClO2易炸,当空气中ClO2的浓度大于10%容易爆炸.回答下列问题:
(1)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
用pH试纸检验溶液的pH
用pH试纸检验溶液的pH
;(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是
a
a
;(填代号)a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)能否将ClO2气体用SO2气体稀释
否
否
(填“能“或“否“),理由是SO2能与ClO2、NaOH、H2O2发生化学反应
SO2能与ClO2、NaOH、H2O2发生化学反应
;(4)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为
3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+
3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+
;(5)为了测定NaClO2?3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/L Na2S2O3标准液滴定,锥形瓶中溶液
蓝色变为无色
蓝色变为无色
(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.00mL,试样纯度是否合格合格
合格
(填“合格”或“不合格”,合格纯度在90%以上).提示:2Na2S2O3+I2═Na2S4O6+2NaI.