网址:http://m.1010jiajiao.com/timu3_id_378121[举报]
用石灰乳、石灰氮(CaCN2)和炼厂气(含H2S)反应,既能净化尾气,又能获得应用广泛的CS(NH2)2(硫脲),其部分工艺流程如下:

(1)高温下,H2S存在下列反应:2H2S(g)
 2H2(g)+S2(g),其平衡常数表达式为K=。
2H2(g)+S2(g),其平衡常数表达式为K=。
(2)用石灰乳吸收H2S制取Ca(HS)2需要在低温下进行,其原因是 ;过滤得到的滤渣可再利用,滤渣的主要成分是 (填化学式)。
(3)合成硫脲需长时间搅拌,并在较高温度(80℃-85℃)下进行,其目的是 。
Ca(HS)2与CaCN2在水溶液中合成硫脉的化学方程式为 。
(4)化合物X与硫脲互为同分异构体,X加入FeCl3溶液中,溶液显红色,X的化学式为 。
查看习题详情和答案>>
进行污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz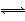 Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 ????????????????????????????????????????????????????? ,
萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是 。
(2)如图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。

某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH= 。
②当调节pH=2时,铋(Bi)的存在形式有 ,其物质的量之比为 。
③萃取到CCl4中的Zn(HDz)2分液后,加入足量NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式: ?????????????????????????????????????????????????????
(3)污水中的亚汞离子(H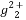 )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H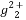 生成硫酸汞,写出该反应的化学方程式: 。
生成硫酸汞,写出该反应的化学方程式: 。
查看习题详情和答案>>
(1)试分析“氢能”将是未来21世纪最理想的新能源的原因 ____________________;____________________(指出两个优点即可).
(2)目前世界上的氢气绝大部分是从石油、煤炭和天然气中制取.请写出工业上由天然气与H2O(g)反应制氢气的化学反应方程式____________________.
(3)利用硫-碘热循环法制取氢气也是化学家常用的一种方法,总反应方程式为
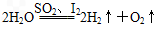 ,其循环过程分三步进行:
,其循环过程分三步进行: (a)SO2+I2+H2O→A(________)+B(________)
(b)A(________)→________+________
(c)B(________)→________+________+________
(d)完成以上三步反应,并确定最难进行的反应为________.
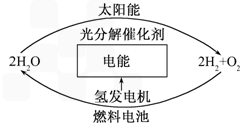
(4)目前,有人提出一种最经济最理想的获得氢能源的循环体系,如下图所示:
(14分)不同的金属在化学反应中表现出来的活泼程度不同,瑞典化学家贝采里乌斯和俄国化学家贝开托夫称之为金属活动顺序。另一方面,同一金属在不同条件或不同化学反应中也可以表现出不同的活泼程度。
⑴根据金属活动性顺序,工业上冶炼金属可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属有 。
腐蚀速率/g.m-2.h-1
 ⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑶合金Fe-Cr在不同酸中反应情况不同,其在三种稀硫
酸、稀硝酸和稀盐酸中的腐蚀速率如图所示,则下列
有关说法正确的是 (填写序号)。
A.酸的氧化性越强,对该合金的腐蚀速率越大
B.稀硝酸对该合金的腐蚀性比另两种酸弱
C.合金中Cr含量增加,稀硝酸对该合金的腐蚀性减弱
⑷已知粗铜中含有少量的锌、铁、银、金等金属和少量
|
以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,
并对阳极泥和电解液中金属进行回收。
步骤一:电解精制
电解时,粗铜应与电源的 极相连。电解过程中,硫酸铜的浓度会 (填“变大”、“不变”或“变小”)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl- = AuCl4- | >>1 |
从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因: 。
查看习题详情和答案>>回答下列问题:
(1)下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是________(填编号).其中根据物质沸点不同分离物质的仪器是________.
(2)实验室有贮存以下物质的方法:A.少量白磷贮存在水中;B.水玻璃贮存在带玻璃塞的玻璃瓶中;C.少量晶体碘贮存在酒精中;D.浓硝酸贮存在棕色的细口玻璃瓶中.其中正确的________(填编号).
(3)苯酚溶液不小心沾到皮肤上,应立即用________擦洗后,再用水洗.试管上附有硫时用________洗涤.
(4)如图分别是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是________.

[ ]
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为3.5mL
D.②是温度计,点数是2.5℃
查看习题详情和答案>>