摘要:4. 某金属氧化物在光照条件下可生成具有很强氧化性的物质.有用来消除空气或水中的污染物.下列关于该金属氧化物应用的叙述不正确的是 A. 将形成酸雨的SO2氧化成SO3 B. 将家居装修挥发出来的甲醛氧化成CO2和H2O C. 将医疗废水中的苯酚氧化成CO2和H2O D. 将电镀废水的的氰根离子CN-氧化成CO2和N2
网址:http://m.1010jiajiao.com/timu3_id_37805[举报]
|
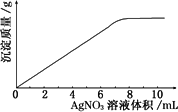
在5 mL 0.05 mol·L-1的某金属氯化物溶液中,滴加0.1 mol·L-1 A g NO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为
| |
| [ ] | |
A. |
+1 |
B. |
+2 |
C. |
+3 |
D. |
+4 |
(2013?淄博一模)下列实验能达到预期目的是( )
|
查看习题详情和答案>>
相同条件下,下列有关溶液的比较中,不正确的是( )
①pH=2的CH3COOH溶液 ②pH=2的HCl溶液 ③pH=12的氨水 ④pH=12的NaOH溶液.
①pH=2的CH3COOH溶液 ②pH=2的HCl溶液 ③pH=12的氨水 ④pH=12的NaOH溶液.
| A、水电离出的c(H+):①=②=③=④ | B、将②、③溶液混合后pH=7,消耗溶液的体积:②>③ | C、将等体积的①、②溶液分别与足量铝粉反应,生成H2的量①更多 | D、分别向等体积的四种溶液中加水稀释至100 mL后,溶液的pH:③>④>①>② |
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.(1)将一小块金属钠投入盛有水的烧杯中,发生反应的化学方程式为:
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
,可观察到的实验现象是
bc
bc
(填序号).a.钠沉到水底 b.钠熔成小球 c.钠球四处游动 d.溶液呈红色
(2)在钠、铝、铁三种金属元素中,其所形成氧化物种类最多的是
铁
铁
,所形成的氧化物中适宜做耐火材料的是
铝
铝
.向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+
Al3++3NH3.H2O=Al(OH)3↓+3NH4+
,得到的胶状沉淀物因具有吸附性或弱碱
吸附性或弱碱
性,可用于吸附性、净水或治疗胃酸过多
吸附性、净水或治疗胃酸过多
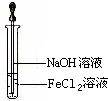
.(3)取少量FeCl2溶液,按如图所示的操作,使其跟NaOH溶液反应.可观察到的现象是
产生白色沉淀,迅速变灰绿,直至红褐色
产生白色沉淀,迅速变灰绿,直至红褐色
,与上述现象相关的反应的化学方程式:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
.(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
B
B
.A.有铜无铁B.有铁无铜 C.铁、铜都有 D.铁、铜都无.