题目内容
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.(1)将一小块金属钠投入盛有水的烧杯中,发生反应的化学方程式为:
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
,可观察到的实验现象是
bc
bc
(填序号).a.钠沉到水底 b.钠熔成小球 c.钠球四处游动 d.溶液呈红色
(2)在钠、铝、铁三种金属元素中,其所形成氧化物种类最多的是
铁
铁
,所形成的氧化物中适宜做耐火材料的是
铝
铝
.向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+
Al3++3NH3.H2O=Al(OH)3↓+3NH4+
,得到的胶状沉淀物因具有吸附性或弱碱
吸附性或弱碱
性,可用于吸附性、净水或治疗胃酸过多
吸附性、净水或治疗胃酸过多
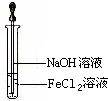
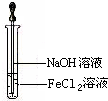
.(3)取少量FeCl2溶液,按如图所示的操作,使其跟NaOH溶液反应.可观察到的现象是
产生白色沉淀,迅速变灰绿,直至红褐色
产生白色沉淀,迅速变灰绿,直至红褐色
,与上述现象相关的反应的化学方程式:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
.(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
B
B
.A.有铜无铁B.有铁无铜 C.铁、铜都有 D.铁、铜都无.
分析:(1)钠的密度小于水,且熔点较小,钠和水反应生成氢气和氢氧化钠,所以其溶液呈碱性;
(2)钠的氧化物有氧化钠和过氧化钠,铝的氧化物有氧化铝,铁的氧化物有氧化亚铁、氧化铁和四氧化三铁;
适合作耐火材料的氧化物必须具有高熔点;铝离子和氨水反应生成氢氧化铝;
氢氧化铝胶体具有吸附性,所以能净水,且氢氧化铝具有弱碱性,能和酸反应;
(3)氯化亚铁和氢氧化钠反应生成白色氢氧化亚铁沉淀,氢氧化亚铁不稳定易被氧化生成氢氧化亚铁沉淀;
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,当铁少量时,铁先和铁离子反应,铜再和铁离子反应,当铁过量时,铁先和铁离子反应后和铜离子反应.
(2)钠的氧化物有氧化钠和过氧化钠,铝的氧化物有氧化铝,铁的氧化物有氧化亚铁、氧化铁和四氧化三铁;
适合作耐火材料的氧化物必须具有高熔点;铝离子和氨水反应生成氢氧化铝;
氢氧化铝胶体具有吸附性,所以能净水,且氢氧化铝具有弱碱性,能和酸反应;
(3)氯化亚铁和氢氧化钠反应生成白色氢氧化亚铁沉淀,氢氧化亚铁不稳定易被氧化生成氢氧化亚铁沉淀;
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,当铁少量时,铁先和铁离子反应,铜再和铁离子反应,当铁过量时,铁先和铁离子反应后和铜离子反应.
解答:解:(1)钠和水反应生成氢氧化钠和氢气,反应方程式为:2 Na+2 H2O=2 NaOH+H2↑,钠的密度小于水,所以钠会浮在水面上,且熔点较小,钠和水反应生成氢气和氢氧化钠,所以钠会熔成小球,生成的氢气使钠受力不均而四处游动,钠的水溶液呈碱性,故答案为:2Na+2 H2O=2 NaOH+H2↑;b、c;
(2)钠的氧化物有氧化钠和过氧化钠,铝的氧化物有氧化铝,铁的氧化物有氧化亚铁、氧化铁和四氧化三铁,所以形成氧化物最多的金属是铁;
适合作耐火材料的氧化物必须具有高熔点,氧化铝的熔点较高,所以氧化铝可以作耐火材料;
铝离子和氨水反应生成氢氧化铝,离子反应方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
氢氧化铝胶体具有吸附性,所以能净水,且氢氧化铝具有弱碱性,能和胃酸反应,所以能治疗胃酸过多;
故答案为:铁、铝,Al3++3NH3.H2O=Al(OH)3↓+3NH4+,吸附性、净水或弱碱性、治疗胃酸过多;
(3)氯化亚铁和氢氧化钠反应生成白色氢氧化亚铁沉淀,迅速变为灰绿色,氢氧化亚铁不稳定易被氧化生成氢氧化亚铁红褐色沉淀,涉及的反应方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓;
故答案为:产生白色沉淀,迅速变灰绿,直至红褐色;FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓;
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,
A.加入铁和铜的混合物,铁首先与氯化铁反应,可能铁全部反应而铜有剩余,故A正确;
B.加入铁和铜的混合物,铁首先与氯化铁反应,铜后参加反应,不会出现有铁无铜的情形,故B错误;
C.若氯化铁的量少,加入的铁粉和铜粉可能剩余,故C正确;
D.若氯化铁的量多,加入的铁粉和铜粉全部参加反应,不会有剩余,故D正确;
故选B.
(2)钠的氧化物有氧化钠和过氧化钠,铝的氧化物有氧化铝,铁的氧化物有氧化亚铁、氧化铁和四氧化三铁,所以形成氧化物最多的金属是铁;
适合作耐火材料的氧化物必须具有高熔点,氧化铝的熔点较高,所以氧化铝可以作耐火材料;
铝离子和氨水反应生成氢氧化铝,离子反应方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
氢氧化铝胶体具有吸附性,所以能净水,且氢氧化铝具有弱碱性,能和胃酸反应,所以能治疗胃酸过多;
故答案为:铁、铝,Al3++3NH3.H2O=Al(OH)3↓+3NH4+,吸附性、净水或弱碱性、治疗胃酸过多;
(3)氯化亚铁和氢氧化钠反应生成白色氢氧化亚铁沉淀,迅速变为灰绿色,氢氧化亚铁不稳定易被氧化生成氢氧化亚铁红褐色沉淀,涉及的反应方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓;
故答案为:产生白色沉淀,迅速变灰绿,直至红褐色;FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓;
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,
A.加入铁和铜的混合物,铁首先与氯化铁反应,可能铁全部反应而铜有剩余,故A正确;
B.加入铁和铜的混合物,铁首先与氯化铁反应,铜后参加反应,不会出现有铁无铜的情形,故B错误;
C.若氯化铁的量少,加入的铁粉和铜粉可能剩余,故C正确;
D.若氯化铁的量多,加入的铁粉和铜粉全部参加反应,不会有剩余,故D正确;
故选B.
点评:本题考查了金属及其化合物的性质,明确物质的性质是解本题关键,难点是(4)题的分析,注意离子反应的先后顺序,难度中等.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.