摘要:西9.X.Y.Z.W均为短周期元素.它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是 A.原子半径:W>Z>Y>X B.Y的气态氢化物的稳定性较Z的强 C.W的最高价氧化物对应水化物的酸性较Z的强 D.四种元素的单质中.Z的熔.沸点最高 北京市各城区二模化学选择题练习六
网址:http://m.1010jiajiao.com/timu3_id_378029[举报]
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.下列说法不正确的是( )
查看习题详情和答案>>
下图是依各个原子的性质和原子序数(1~20)画的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、最高正价、原子半径相对大小、得电子相对能力.图2中原子序数8、9和图3中原子序数2、10、18在纵轴上没有对应的数值.

(1)图1~图3的纵轴分别代表
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中.B是生命体的构架元素,E是同周期中半径最小的元素,G的最外层电子数比次外层电子数少2个.它们的原子序数存在如下关系:①a+b=c,②
=c,③
=d,请根据提供的信息,回答下列问题:
①如图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置;
②写出铜与C元素最高价氧化物对应水化物的浓溶液反应的化学 方程
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W.若X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,其相应的化学方程式为
查看习题详情和答案>>

(1)图1~图3的纵轴分别代表
质子数
质子数
、最高正价
最高正价
、得电子相对能力
得电子相对能力
;(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中.B是生命体的构架元素,E是同周期中半径最小的元素,G的最外层电子数比次外层电子数少2个.它们的原子序数存在如下关系:①a+b=c,②
| (b+d) |
| 2 |
| (c+e) |
| 2 |
①如图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置;

②写出铜与C元素最高价氧化物对应水化物的浓溶液反应的化学 方程
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
;③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W.若X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,其相应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是
(2)ZW2常温下呈液态,形成晶体时,属于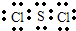
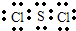 .
.
(3)工业生产单质Y的原理是
(4)X与Y化学性质相似,则等物质的量的X与Y与足量的浓NaOH溶液反应产生的H2的物质的量之比为
(5)0.1mol的单质W与50mL 1.5mol?L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是
查看习题详情和答案>>
(1)Y、Z、W的原子半径由小到大的顺序是
Cl<S<Al
Cl<S<Al
(用对应元素符号表示).(2)ZW2常温下呈液态,形成晶体时,属于
分子
分子
晶体,它的电子式是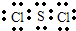
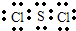
(3)工业生产单质Y的原理是
2Al2O3(熔融)
4Al+3O2↑
| ||
2Al2O3(熔融)
4Al+3O2↑
(用化学方程式表示).
| ||
(4)X与Y化学性质相似,则等物质的量的X与Y与足量的浓NaOH溶液反应产生的H2的物质的量之比为
2:3
2:3
.(5)0.1mol的单质W与50mL 1.5mol?L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是
3:5
3:5
.(2010?信阳二模)X、Y、Z、W是原子序数依次增大的短周期元素,且均在不同族,其中两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.下列说法不正确的是( )
查看习题详情和答案>>
(2013?黄山一模)X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示.
填写下列空白:
(1)X有多种同素异形体,写出X2电子式是
 ,
,
(2)X,Y,Z三种元素电负性由大到小顺序为
(3)W元素原子基态时原子的电子排布式
(4)Z位于元素周期表第
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH
(6)25℃、101kPa时,32g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式
查看习题详情和答案>>
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X有多种同素异形体,写出X2电子式是


(2)X,Y,Z三种元素电负性由大到小顺序为
Cl>S>C
Cl>S>C
.(3)W元素原子基态时原子的电子排布式
1s22s22p63s23p1
1s22s22p63s23p1
.(4)Z位于元素周期表第
三
三
周期第ⅦA
ⅦA
族(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH
<
<
7(填“=”、“>”或“<”),理由是:Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
(用离子方程式表示).(6)25℃、101kPa时,32g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
.