网址:http://m.1010jiajiao.com/timu3_id_378018[举报]
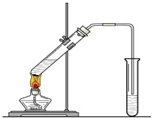 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:
(3)浓硫酸的作用是:①
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
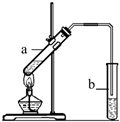 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O(2)浓硫酸的作用是:①
(3)饱和碳酸钠溶液的主要作用是
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
 某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.【实验一】探究浓硫酸的氧化性
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲.(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,请指出:
(2)写出装置甲中反应的化学方程式
| ||
 CO2↑+2SO2↑+2H2O)
CO2↑+2SO2↑+2H2O)
| ||
 CO2↑+2SO2↑+2H2O)
CO2↑+2SO2↑+2H2O)(3)装置乙中的试剂是
【实验二】探究某硫酸亚铁盐固体是否变质
(4)请你帮助该同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如图:

该同学用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数.
①取5.00mL H2O2溶液(密度为1.00g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL.
回答下列问题:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快.Mn2+的作用是
(7)写出该滴定反应的离子方程式:
(8)原H2O2溶液中溶质的质量分数为
(10分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+6 H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ 6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v (CO2) 表示的反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 (填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。

① 该电池正极的电极反应为
。
②该电池工作时,溶液中的OH-向______极移动。
查看习题详情和答案>>
(13分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数K=_________,该反应为 (填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
。
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
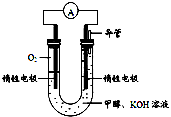
①该电池负极的电极反应为: 。
②该电池工作时,溶液中的OH-向______极移动。 查看习题详情和答案>>