摘要:元素A的原子最外层电子数是a.次外层电子数是b;元素B的原子M层电子数是.A.B两种元素形成的化合物的化学式可表示为 A.B3A2 B.BA2 C.A3B2 D.AB2
网址:http://m.1010jiajiao.com/timu3_id_377912[举报]
元素周期表、平衡移动原理是化学反应原理中的重要内容.请回答下列问题:现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)①A~F六种元素原子,原子半径最大的是
②A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:
 .
.
③B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:
④A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为:
(2)在一定温度下,向一个体积为1.0L的密闭容器中,通入3mol SO2 和2mol O2及固体催化剂,使之反应:2SO2(g)+O2(g) 2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.
2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.
①加入3mol SO2 和2mol O2 发生反应,达到平衡时放出的热量为
②该温度下反应的平衡常数是
查看习题详情和答案>>
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)①A~F六种元素原子,原子半径最大的是
D
D
(填序号).②A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:


③B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:
HClO和NH3(NH3?H2O)
HClO和NH3(NH3?H2O)
.④A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(2)在一定温度下,向一个体积为1.0L的密闭容器中,通入3mol SO2 和2mol O2及固体催化剂,使之反应:2SO2(g)+O2(g)
 2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.
2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.①加入3mol SO2 和2mol O2 发生反应,达到平衡时放出的热量为
98.3KJ
98.3KJ
②该温度下反应的平衡常数是
0.167
0.167
.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色
(1)B元素在元素周期表中的位置
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
(3)写出B的单质和H的最高价氧化物对应水化物反应的离子方程式:
(4)H、E形成原子个数比为1:1的化合物含有的化学键类型为
(5)A、B、C、D四种元素的原子半径由小到大的顺序为(填元素符号)
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
(1)B元素在元素周期表中的位置
第三周期第ⅢA族
第三周期第ⅢA族
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
HClO4
HClO4
(填化学式).(3)写出B的单质和H的最高价氧化物对应水化物反应的离子方程式:
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(4)H、E形成原子个数比为1:1的化合物含有的化学键类型为
离子键和非极性键
离子键和非极性键
.(5)A、B、C、D四种元素的原子半径由小到大的顺序为(填元素符号)
Cl<S<Al<Mg
Cl<S<Al<Mg
.(7分)元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
| A | | | |||||||||||||||
| | | | | D | E | | | | |||||||||
| G | | | Q | | M | R | | ||||||||||
| | | | | | | | T | | | | | | | | | | |
 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。(3)M、D两种元素形成的化合物含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;
A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式) 。
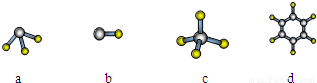
A与D形成分子的空间结构可能是(填序号) 。(2分)
 查看习题详情和答案>>
查看习题详情和答案>>
(14分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置___________________,上述八种元素的最高价氧化物对应的水化物中酸性最强的是__________,A离子的结构示意图_______________。
(2)用电子式表示A、D形成化合物的过程:____________________________________。H、E形成原子个数比为1:1的化合物的电子式为___________,含有的化学键类型为____________。C2D2的电子式为______________________。
(3)下列说法能说明D的非金属性比C强的选项____________
①H2CO4比HDO稳定②HDO4比H2CO4酸性强③C2-比D-易被氧化④HD比H2C稳定⑤铜与HD不反应,但能与浓H2CO4反应⑥铁与D2加热生成FeD3,铁与C加热生成FeC⑦C原子与D原子电子层数相同,D原子半径小于C原子。
A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为_______________________。(用具体离子符号表示)
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程_______________________________________,氧化剂与还原剂的质量之比_____________________。 查看习题详情和答案>>
元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素.请依据这9种元素回答下列问题.
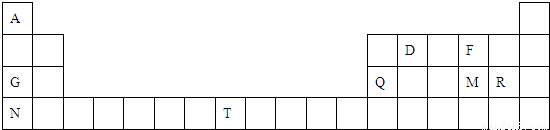
(1)表中T的元素符号为______,金属性最强的元素是______(填元素符号).
(2)元素的非金属性:M______R(填“>”或“<”).
(3)R的最高价氧化物对应水化物的化学式是______.
(4)F、G两元素形成的淡黄色固体物质的电子式为______,该物质含有的化学键的类型是______.
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是______(填离子符号).
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为______.
(7)A与D形成分子的空间结构可能是(填序号)______.
查看习题详情和答案>>

(1)表中T的元素符号为______,金属性最强的元素是______(填元素符号).
(2)元素的非金属性:M______R(填“>”或“<”).
(3)R的最高价氧化物对应水化物的化学式是______.
(4)F、G两元素形成的淡黄色固体物质的电子式为______,该物质含有的化学键的类型是______.
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是______(填离子符号).
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为______.
(7)A与D形成分子的空间结构可能是(填序号)______.

查看习题详情和答案>>