网址:http://m.1010jiajiao.com/timu3_id_377771[举报]
(14分)HNO3是极其重要的化工原料。工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的。(1)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失)。
① 试写出上述反应的化学方程式。
② 设循环操作的次数为n,试写出NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式。
③ 计算一定量的二氧化氮气体要经过多少次循环操作,才能使95%的二氧化氮转变为硝酸?
(2) 上述方法制备的HNO3为稀硝酸,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:c<6.6 mol/L;N2和NH4+:c<10 mol/L;NO:0.1 mol/L<c<10 mol/L;NO2:c>0.1 mol/L。各气相产物成分及含量随HNO3浓度变化曲线如下图所示。
④ 写出Mg与11 mol/L的HNO3反应的方程式;
⑤ 960 mg Mg与一定体积4 mol/L的HNO3恰好完全反应,收集到224 mL气体(S.T.P)气体,试通过计算写出反应方程式。
查看习题详情和答案>>硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是 。
②装置Ⅲ中发生反应的化学方程式为 。
③蘸NaOH溶液的棉花团的作用是 。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO 。
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
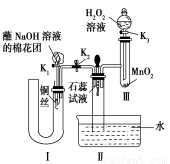
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是 。
②装置Ⅲ中发生反应的化学方程式为 。
③蘸NaOH溶液的棉花团的作用是 。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO 。
查看习题详情和答案>>
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
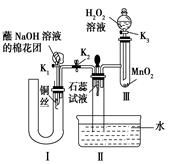
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是 。
②装置Ⅲ中发生反应的化学方程式为 。
③蘸NaOH溶液的棉花团的作用是 。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO 。
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
______________________________________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。

①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是____________________________________________________。
②装置Ⅲ中发生反应的化学方程式为_______________________________。
③蘸NaOH溶液的棉花团的作用是___________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO__________________________________________________。
查看习题详情和答案>>