摘要:室温下.在pH=12的某溶液中.由水电离的c( OH-) 为 A.1.0×10-7mol·L-1 B.1.0×10-6mol·L-1 C.1.0×10-2mol·L-1 D.1.0×10-12mol·L-1
网址:http://m.1010jiajiao.com/timu3_id_377557[举报]
 Ⅰ.室温时1L 0.01mol?L-1的硫酸氢钠溶液的pH为
Ⅰ.室温时1L 0.01mol?L-1的硫酸氢钠溶液的pH为2
2
,在其中滴入等体积的0.01mol?L-1的Ba(OH)2溶液后,加水稀释到10L,所发生反应的离子方程式为Ba2++OH-+H++SO42-═BaSO4↓+H2O
Ba2++OH-+H++SO42-═BaSO4↓+H2O
,pH为11
11
.Ⅱ.某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)
①
①
,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)偏大
偏大
.(2)判断滴定终点的现象是:
无色变为粉红,半分钟内不变色
无色变为粉红,半分钟内不变色
.(3)如下图是某次滴定时的滴定管中的液面,其读数为
22.60
22.60
mL.(4)根据下列数据:请计算待测盐酸溶液的浓度:
0.2000
0.2000
mol/L.| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
(Ⅰ)FeCl3的水溶液呈
实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以
(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题: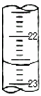
(1)某次滴定时的滴定管中的液面如图所示,其读数为
(2)根据下列数据:
请计算待测烧碱溶液的浓度为
(3)下列实验操作会使实验结果偏高的是
A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡.
查看习题详情和答案>>
酸性
酸性
(填“酸性”、“碱性”或“中性”),原因是Fe3++3H2O?Fe(OH)3+3H+;
Fe3++3H2O?Fe(OH)3+3H+;
(用离子方程式表示);实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以
抑制
抑制
(填“促进”、“抑制”)其水解;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3
Fe2O3
.(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:

(1)某次滴定时的滴定管中的液面如图所示,其读数为
22.60
22.60
mL.(2)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
0.1250
0.1250
mol/L.(3)下列实验操作会使实验结果偏高的是
A、B、C、D
A、B、C、D
.A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡.
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
(2)取10.00mL待测液,用
(3)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视
(4)根据下列数据,烧碱的纯度为
(5)排去碱式滴定管中气泡的方法应采用操作

(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、锥形瓶用蒸馏水洗后又用待测液润洗
E、滴定到指示剂刚变色,摇动锥形瓶后颜色褪去,没再继续滴定
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
查看习题详情和答案>>
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
.(2)取10.00mL待测液,用
碱
碱
式滴定管量取.(3)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视
锥形瓶中溶液颜色的变化
锥形瓶中溶液颜色的变化
,直到滴定到终点.(4)根据下列数据,烧碱的纯度为
93.5%
93.5%
.(用百分数表示)| 滴定次数 | 待测液体积 (mL) |
标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
丙
丙
(填“甲”、“乙”、“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
ABDF
ABDF
.(多选扣分)A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、锥形瓶用蒸馏水洗后又用待测液润洗
E、滴定到指示剂刚变色,摇动锥形瓶后颜色褪去,没再继续滴定
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
(2013?江苏二模)900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: . .经一段时间后达到平衡.反应过程中测定的部分数据见下表:
|
查看习题详情和答案>>
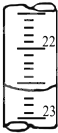 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:(1)以上步骤有错误的是(填编号)
①
①
,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)偏大
偏大
;(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无响”)
偏小
偏小
;(3)判断滴定终点的现象是:锥形瓶中溶液从
无
无
色变为粉红
粉红
色,且半分钟不变色;(4)右图是某次滴定时的滴定管中的液面,其读数为
22.60
22.60
mL;(5)根据下列数据:请计算待测盐酸溶液的浓度:
0.2000
0.2000
mol/L.| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |